
题目列表(包括答案和解析)
13.( )按照下列有关方法进行实验,实验结果偏大的是
A.测定硫酸铜晶体中结晶水含量,失水后的硫酸铜置于空气中冷却后再测质量
B.测定中和热实验中,所使用的稀NaOH溶液的物质的量稍大于稀盐酸
C.配制一定物质的量浓度的溶液实验中,容量瓶内壁附有蒸馏水
D.用标准盐酸滴定未知浓度的氢氧化钠溶液,开始时俯视读数,终点时仰视读数
12.( )下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、 C6H5O-、Na+、K+
C.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2-
11.( )化合物M叫假蜜环菌甲素,它是香豆素类天然化合物。对M的性质叙述正确的是
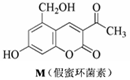 A.M与Br2只能发生取代反应,不能发生加成反应
A.M与Br2只能发生取代反应,不能发生加成反应
B.M能与FeCl3发生反应,但不能与CH3COOH发生反应
C.M可溶于NaOH稀溶液,1molM最多消耗3mol NaOH
D.1molM在催化剂作用下最多能与4molH2发生加成反应
10.( )碘是卤素中原子半径较大的元素,有时可呈现金属性。下列事实能说明该结论的是
A.HIO在水溶液中存在电离平衡:HIO I++OH- B.I(NO3)3晶体中含有I 3+离子
I++OH- B.I(NO3)3晶体中含有I 3+离子
C.化合物HIO4具有酸性 D.IBr、ICl等卤素互化物为共价化合物
9.( )NA代表阿伏加德罗常数值,下列说法正确的是
A.22.4 L N2中所含的共用电子对的数目为3NA
B.标准状况下,22.4 L NO2和N2O4的混合物所含的分子数为NA
C.56g铁与足量硝酸反应转移的电子数为2NA D.78gNa2O2中含有的离子数为4NA
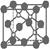
8.( )磷化硼是一种超硬耐磨涂层材料。右图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是
A.磷化硼晶体的化学式为BP,属于离子晶体 B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4根共价键 D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
7.( )下列反应的离子方程式正确的是
A.碳酸氢铵溶液与过量氢氧化钠溶液反应:NH4++OH-=NH3·H2O
B.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
 C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-→CaCO3↓+CO32-+2H2O
C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-→CaCO3↓+CO32-+2H2O
 D.用惰性电极电解MgCl2溶液:2H2O + 2Cl- Cl2↑+ H2↑+
2OH-
D.用惰性电极电解MgCl2溶液:2H2O + 2Cl- Cl2↑+ H2↑+
2OH-
6.( )下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是
A.蔗糖 B.麦芽糖 C.油脂 D.淀粉
5.( )高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂。工业上可先制得高铁酸钠(离子反应为2Fe(OH)3 +3C1O-+ 4OH-= 2FeO42-+ 3Cl- + 5H2O),然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾。下列说法不正确的是
A.高铁酸钠溶解度比高铁酸钾大 B.每生成l mol Na2FeO4,转移3 mol电子
C.高铁酸钾不仅能消毒杀菌,还能除去水中的还原性杂质
D.高铁酸钾溶液是胶体,能吸附水中的悬浮杂质
4.( )超酸是指酸性比普通无机酸强106~1010倍的酸,魔酸(HSO3F-SbF5)是已知超酸中最强的,许多物质如H2SO4在魔酸中可获得质子。则硫酸溶于魔酸中所表现出的这种性质是
A.碱性 B.酸性 C.还原性 D.氧化性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com