
题目列表(包括答案和解析)
13.碱性电池具有容量大、放电电流大的特点,因而得到广泛的应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O=Zn(OH)2(s)+Mn2O3(s)。下列说法正确的是
A.电池工作时,锌为正极 B.电池工作时,电子有正极通过外电路流向负极
C.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
D.外电路中每通过0.2mol电子,锌的质量理论上减小13g
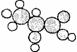
12.下图是一种有机物的比例模型。该模型代表的有机物可能是
A.羟基羧酸 B.饱和一元醇 C.羧酸酯 D.饱和一元醛
11.韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。下列关于“暖冰”的说法不正确的
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
 D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
10.下列物质中不会因见光而分解的是
A.NaHCO3 B.HNO3 C.AgI D.HClO
9.锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大量推广,且对环境无污染。电池总反应式为;V2O5+ xLi→LixV2O5 , 下列说法不正确的是
A.向外供电时,锂离子在凝胶中向正极 B.正极材料是锂,负极材料为V2O5
C.正极的电极反应为:V2O5+xe-+ xLi+ →Lix V2O5 D. 负极的电极反应为:xLi-xe一→ xLi+
8.下列叙述不正确的是
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.将Cl2和SO2分别通入到品红溶液中,均能使品红溶液退色
C.反应AgCl + NaBr AgBr
+ NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
AgBr
+ NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
7.利用相关数据作出的推理或判断不正确的是
A.用键能大小的数据,可判断分子的稳定性 B.用原子半径的数据,可推断元素的主要化合价
C.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来
D.用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3
6.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和苯分别受热变为气体 B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中
5.亚硝酸盐中毒,又名乌嘴病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是
A.在中毒过程中血红蛋白被氧化 B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性 D.解毒时高铁血红蛋白被还原
4.运用元素周期表的知识分析下面推断,其中错误的是
A.已知Cs是第六周期ⅠA族元素,故CsOH的碱性比NaOH的碱性强
B.巳知Se是第四周期ⅥA族元素,故H2Se的稳定性比H2S的稳定性弱
C.巳知K的原子半径比Na的原子半径大,故K与水反应比Na与水反应更剧烈
D.巳知P的核电荷数比Na的核电荷数大,故P的原子半径比Na的原子半径大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com