
题目列表(包括答案和解析)
24.分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
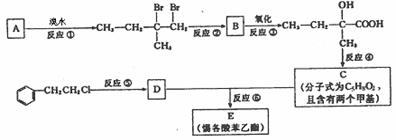 为了合成该物,某实验室的科技 人员设计了下列合成路线:试回答下列问题:
为了合成该物,某实验室的科技 人员设计了下列合成路线:试回答下列问题:
(1) 试写出:A的结构简式
B的结构简式
(2) 反应②中另加的试剂是 _______________;反应④的一般条件是 。
(3) 试写出反应生成E的化学方程式:
(4) 上述合成路线中属于取代反应的是 (填编号)。
23. 在某一容积为VL的密闭容器内,加入等物质的量的X和Y,在一定的条件下发生如下反应:X(g)+Y(g)
在某一容积为VL的密闭容器内,加入等物质的量的X和Y,在一定的条件下发生如下反应:X(g)+Y(g)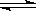 2Z (g)。(正反应是放热反应)(1)反应达到平衡后,降低温度,化学反应速率
,Z的浓度
。(填“增大”、“减小”或“不变”)。
2Z (g)。(正反应是放热反应)(1)反应达到平衡后,降低温度,化学反应速率
,Z的浓度
。(填“增大”、“减小”或“不变”)。
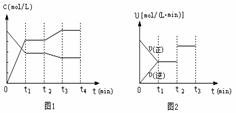
(2)图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2 min时,曲线发生变化的原因是
(用文字表达)。由图2判断,t2 min到t3 min 的曲线变化的原因可能是 (填编号)
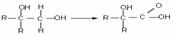 a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
22.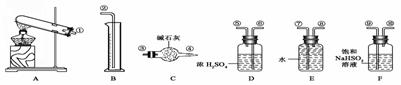 某化学课外活动小组,从化学手册上查得硫酸铜在500 ℃以上按下式分解:CuSO4
某化学课外活动小组,从化学手册上查得硫酸铜在500 ℃以上按下式分解:CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
实验测得数据及有关结果如下:
①准确称取6.0 g无水CuSO4;②干燥管总质量在实验结束时增加了2.4 g;③测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为280 mL;④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其他杂质,且O2在其中的损耗可忽略不计)。试回答下列问题:
(1)按装置从左至右的方向,各仪器连接顺序为 (填代号)。
(2)装置F的作用是 。
(3)装置D的作用是 。
(4)确定装置E的进、出口的原则是: 。
(5)首先应计算的是物质 的体积;通过计算,推断出该条件下反应的化学方程式:
(6)该实验设计中,可能给测定带来误差最大的装置是___________________(填代号)。
21.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)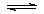 3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A.4molA、4molB B.2molA、1molB和1molHe(不参加反应)
C.1molB和1molC D.2molA、3molB和3molC
20.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A.Ca2+、K+、Cl- S2O32-、 B.NH4+、Fe2+、 I一、NO3-
C.Na+ 、K+、ClO-、S2- D.Na+、Cl-、SO42-、K+
19. a mol FeS与b mol FeO投入到V L、C mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)g C.(a+b)mol D.(CV-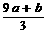 )mol
)mol
18.设NA代表阿佛加德罗常数,下列说法中正确的是
①常温常压下,17g甲基(-14CH3)所含的中子数为9NA ②常温常压22.4L NO气体的分子数小于NA ③64g的铜发生氧化还原反应,一定失去2NA个电子 ④7.8 g Na202中含有的阴离子数目约为6.02×1022 ⑤标况时,22.4L二氯甲烷所含有的分子数为4NA ⑥1 mol金刚石中含有c-c键的数目约为6.02×1023
A.①②⑥ B.②④⑤ C.②④ D.⑤⑥
17.一定条件下,可逆反应X(g) + 3Y(g)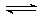 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
16.对于平衡体系:aA(g)+bB(g) cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为M+bmol,则a+b>c+d D.若a+b=c+d ,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变。
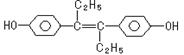
14.己烯雌酚是一种激素类药物,结构如下。下列有关叙述中不正确的是
 A.它易溶于有机溶剂 B.可与NaOH溶液反应
A.它易溶于有机溶剂 B.可与NaOH溶液反应
C.1mol该有机物可以与6mol Br2发生反应
D.该有机物分子中,一定有14个碳原子共平面
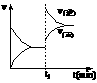 [ ]15.下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
[ ]15.下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2 (g)+O2 (g) 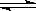 2SO3
(g) ;△H<0
2SO3
(g) ;△H<0
B.4NH3 (g)+O2 (g) 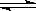 4NO(g)+6H2O
(g) ;△H<0
4NO(g)+6H2O
(g) ;△H<0
C.H2 (g)+I2 (g)
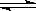 2HI
(g) ;△H>0
2HI
(g) ;△H>0
D.C
(s)+H2O (g) 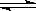 CO (g)+H2
(g) ;△H>0
CO (g)+H2
(g) ;△H>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com