
题目列表(包括答案和解析)
3. 下列实验操作正确的是
①将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较测得该溶液的pH ②使用碱式滴定管盛装KMnO4溶液滴定Na2SO3溶液 ③将3滴浓硫酸滴入蓬松的脱脂棉中搅拌加热,在其中加入2滴2%CuSO4溶液,再加入足量的10%NaOH溶液,并加热至沸腾,可证明纤维素的水解 ④用热水加热乙醛和银氨溶液的混合液做乙醛的银镜实验 ⑤向蛋白质溶液中加入无机盐(如Na2SO4、CuSO4)浓溶液,可使蛋白质盐析而分离提纯 ⑥实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂 ⑦配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加浓硫酸 ⑧检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴-3滴即可
A.①③⑥⑧ B.②③⑥⑧ C.②④⑥⑦ D.③④⑧
2.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中不正确的是
A.钠、镁都是活泼金属,由金属钠和镁引起火灾都不能用干冰灭火器灭火
B.NaHC03溶液能与NaAl02反应生成白色沉淀,NaHS03溶液也能与NaAl02反应生成白色沉淀
C.NH4C1、NH4I结构相似,将两种固体分别加热,都分解生成HX和NH3
D.原电池中通常是活泼金属做负极,不活泼金属做正极,用铜和铝与浓硝酸构成原电池时,铝是正极
27. (1)①沸腾炉 吸收塔
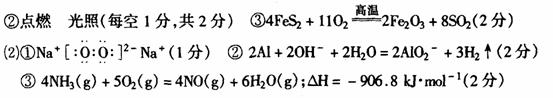
26.
(1) 2NO2 -+ 2I -+ 4H+ =2NO↑ +I2 +2H2O
(2) 2.408×1023 (或0.4NA)
(3)反应生成了NO ,该物质会造成大气污染 ,
还原性 , 强
(4)方法一:取适量样品于两支试管中,分别加入稀盐酸,有气体产生,气体在瓶口变为红棕色的为NaNO2,无明显现象的为NaCl
方法二:取适量样品于两支试管中,分别加入稀盐酸和碘化钾淀粉溶液,若溶液变蓝,证明该物质的是NaNO2;若无明显现象,该物质则是NaCl(其他合理答案也可)(2分)
25.
(1)小 2 (2)液态水中仍然存在大量氢键
(3) 12 1.56
24.
(1)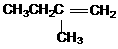 ,
,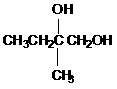 ; (2)NaOH;浓H2SO4/△
; (2)NaOH;浓H2SO4/△
(3)
 (4)② ⑤ ⑥
(4)② ⑤ ⑥
23.减小,增大 t2 时对平衡体系降温 b d
22、(1)A、F、D、C、E、B (2)吸收三氧化硫并放出等物质的量的二氧化硫
(3)干燥二氧化硫和氧气;(4)短进出口长出
(5) O2 、 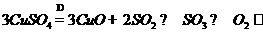
(6) BE
26.亚硝酸钠易溶于水,有碱味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
[ ]NaNO2 + [ ]KI + [ ] _____  [ ]NO +[ ] I2 +[ ] K2SO4 + [ ]Na2SO4 +[ ] _____
[ ]NO +[ ] I2 +[ ] K2SO4 + [ ]Na2SO4 +[ ] _____
⑴根据提示,写出上述反应的离子方程式
(2)在上述反应中,若要生成50.8 g I2,则电子转移了 个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是________________________________________。从环保角度来讲,要处理NaNO2,所用的物质的 (填“氧化性”或“还原性”)应该比KI更____(填“强”或“弱”)。
(4)亚硝酸钠可以与酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2=2NO↑+HNO3+H2O 请用两种简便的化学方法来鉴别亚硝酸钠和氯化钠。
方法一: 。
方法二:
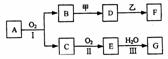 27物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在C的浓溶液中发生钝化。
27物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在C的浓溶液中发生钝化。
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则 ①工业上反应I在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应I的化学方程式是 。
⑵若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。
③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
1C 2A 3A 4D 5B 6A 7B 8D 9B 10A 11B 12A 13C 14D 15B 16B 17C 18C 19D 20D 21B
25.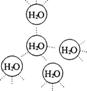 水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体--冰。
水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体--冰。
(1)氢键的形成使冰的密度比水 ,氢键有方向性和饱和性,故平均每个水分子最多形成 个氢键。
(2)实验测得冰中氢键的作用能为18.8 kJ/mol,而冰的熔化热为5.0 kJ/mol,说明
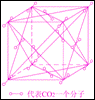 (3)干冰的外观和冰相像,可由二氧化碳气体压缩成液态后再急剧膨胀而制得。右图为干冰晶体结构示意图。通过分析,可知每个CO2分子周围与之相邻等距的CO2分子共
个。一定温度下,已测得干冰晶胞(即图示)的边长a=5.72×10-8cm,则该温度下干冰的密度为
g/cm3。
(3)干冰的外观和冰相像,可由二氧化碳气体压缩成液态后再急剧膨胀而制得。右图为干冰晶体结构示意图。通过分析,可知每个CO2分子周围与之相邻等距的CO2分子共
个。一定温度下,已测得干冰晶胞(即图示)的边长a=5.72×10-8cm,则该温度下干冰的密度为
g/cm3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com