
题目列表(包括答案和解析)
16.甲、乙两容器都发生反应2A(g)+B(g)  xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为w,物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为w,物质的量为n2。下列说法中正确的是
xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为w,物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为w,物质的量为n2。下列说法中正确的是
A.若甲、乙两容器均为恒容容器,则x必等于2 B.若甲、乙两容器均为恒压容器,则x必等于3
C.若甲为恒压容器、乙为恒容容器,且x≠3,则n1必大于n2
D.若甲为恒容容器、乙为恒压容器,且x=3,则n1必大于n2
14.下列离子方程式正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO-2+2H2O
B.向硅酸钠溶液中通入过量的CO2:SiO2-3+2CO2+2H2O=H2SiO3↓+2HCO-3
C.过量铁粉与一定量稀硝酸反应:Fe+4H++NO-3=Fe3++NO↑+2H2O
D. NaHSO4溶液与Ba(OH)2溶液混合呈中性: HSO4-+Ba2++ OH-=BaSO4↓+ + H2O
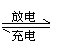 [ ]15.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn
+ 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH下列叙述正确的是
[ ]15.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn
+ 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH下列叙述正确的是
A.放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
B.充电时阴极反应为:Fe(OH)3 -3e- + 5 OH- = FeO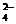 + 4H2O
+ 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 D.放电时正极附近溶液的碱性增强
13.下列有关说法正确的是
A.物质熔沸点的高低顺序是:晶体硅>氯化钠>冰>氖气 B.微粒半径由小到大顺序是:H-<Li+<H+C.溶液中结合H+能力由强到弱的顺序是:SO42- >H2PO4->CH3COO->HCO3-
D.CO2、HClO、CF4、PCl3四种物质分子中的所有原子都满足最外层为8电子的稳定结构
12.在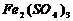 溶液中,加入ag铜,完全溶解后,再加入bg铁,充分反应后得到cg残余固体,且
溶液中,加入ag铜,完全溶解后,再加入bg铁,充分反应后得到cg残余固体,且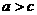 ,则下列说法正确的是
,则下列说法正确的是
A.残余固体全部是铜
B.最后得到的溶液中一定含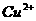 和Fe3+
和Fe3+
C.将残余固体加入到稀H2SO4中,有气泡产生 D.最后得到的溶液中可能含有Fe3+
11.下列各溶液中,微粒的物质的量浓度关系正确的是
A. 10mL 0.5mol/L CH3COONa溶液与5mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B. 0.1mol/L pH为4的NaHB溶液中: c(HB-)>c(B2-)>c(H2B)
C. 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D. c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl)
9.有机物甲分子式为C11H14O2 .在酸性条件下水解生成乙和丙,丙遇FeCl3溶液显紫色,丙的相对分子质量比乙大20,甲的结构有
A.3种 B.4种 C.6种 D.8种
 [ ]10.零排放燃料电池曾被美国《时代》杂志列为21世纪改变人类生活的十大新科技之首。其中质子交换膜燃料电池的工作原理如右图所示,下列选项中不正确的是
[ ]10.零排放燃料电池曾被美国《时代》杂志列为21世纪改变人类生活的十大新科技之首。其中质子交换膜燃料电池的工作原理如右图所示,下列选项中不正确的是
A. 该电池的正极反应式为:O2+4H++4e-==2H2O
B. 该电池的负极反应式为:2H2-4e-== 4H+
C. 该电池的总反应式为:2H2+O2==2H2O
D. 导电离子:H+(质子)由正极定向移动至负极
8.从某些方面看,NH3与H2O,NH 与H3O+、HN
与H3O+、HN 与OH-,N3-与O2-两两相似,据此判断下列反应:①
与OH-,N3-与O2-两两相似,据此判断下列反应:① ②
②
③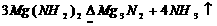 ④
④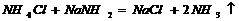 其中正确的是A.只有② B.只有③ C.只有②③ D.都正确
其中正确的是A.只有② B.只有③ C.只有②③ D.都正确
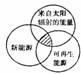
6.“能源分类相关图”如右图所示,四组能源选项中,全部符合图中阴影部分的能源是
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能

 [ ]7对于达到平衡的可逆反应X+Y W+Z,增大压强,则正、逆反应速率(
[ ]7对于达到平衡的可逆反应X+Y W+Z,增大压强,则正、逆反应速率(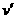 )变化的图象如右图所示,关于X、Y、Z、W物质的聚集状态的说法可能正确的是
)变化的图象如右图所示,关于X、Y、Z、W物质的聚集状态的说法可能正确的是
A.Z、W均匀为气体,X、Y有一种是气体
B.Z、W中有一种是气体,X、Y皆为非气体
C.X、Y、Z皆为气体,W为非气体
D.X、Y均不为气体,W、Z中有一种是气体
5.NA为阿伏加德罗常数,下列说法中不正确的是
A.16.9gBaO2固体中阴、阳离子总数为0.3NA B.2.3g钠被O2完全氧化时,失去电子数为0.1NA
 C.质子总数为5NA的重水(D2O)的物质的量为0.5mol
C.质子总数为5NA的重水(D2O)的物质的量为0.5mol
D.大在标准状况下,11.2L甲烷与乙烯的混合物所含氢原子的数目为2NA
4.将一定量铁粉和硫粉的温合物隔绝空气共热,充分反应后冷却,再加入足量稀H2SO4,得到标准状况下的气体11.2L,则原混合物可能的组成是(n代表物质的量)
A.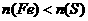 ,总质量等于44g B.
,总质量等于44g B. ,总质量等于44g
,总质量等于44g
C.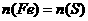 ,总质量大于44g D.
,总质量大于44g D. ,总质量小于44g
,总质量小于44g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com