
题目列表(包括答案和解析)
31.氙有一种化合物XeO3,但极不稳定,易转化为其单质而具有强氧化性,将适量XeO3投入60mL0.1mol/L的Mn(NO3)2的水溶液中恰好完全反应,放出唯一气体氙单质,在标准状况下体积为112mL,则
⑴反应后的溶液中,锰在化合物中的化合价为__________
⑵该反应除有气体生成外,还有一明显的实验现象为
⑶若将所得溶液稀释至180mL,溶液的PH为____________(设生成的酸均为强酸)
30.A、B、D、E是周期表中前20号元素,它们的原子序数依次增大。EA2与水反应产生可燃性气体和白色浆状物,向该浆状物中通入AB2气体可得另一白色不溶物。B、D同主族,D的阴离子与E的阳离子具有相同的核外电子排布。请回答:
(1)写出元素符号:A 、B 。
(2)已知AD2与AB2的结构相似,AD2的结构式为 ,该分子是 (填“极性分子”或“非极性分子”)。
(3)镁条在AB2中燃烧的化学方程式为 。
(4)将D单质放入浓HNO3中加热,生成红棕色气体和一种强酸,该反应的离子方程式为
(5)A可形成二元弱酸H2A2O4。0.1 molH2A2O4与100 mL 2 mol/L的KOH溶液反应后,溶液中的离
子浓度由大到小的排列顺序是 。
29.有X、Y、Z三种同周期的短周期元素,已知:①X2-、Y- 两种离子的最外层电子数均与此外层电子数相等;②Z与Y可组成离子化合物ZY2 请回答:
(1)Y的最高价氧化物对应水化物的化学式是
(2)Z的单质可以在CO2中燃烧,请写出该反应的化学方程式:
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体W。
①已知一定条件下,每1 molW气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则W气体的转化率为: 。
②将足量的W气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种Y的氧化物,同时有1.5mol电子转移,则该Y的氧化物的化学式是: 。
28.烯烃通过臭氧化并经锌和水处理得到醛或酮,例如:
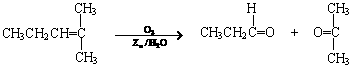
一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。其转化关系如下;
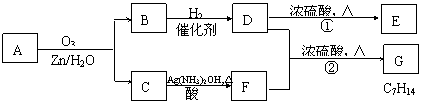
请回答下列问题:
(1) B的相对分子质量是______________。
(2) 写出结构简式:A__________________ 、E_______________________ 。
(3) 写出反应①、②的反应类型:①____________、②_______________。
(4) 写出反应②的化学方程式: 。
27.⑴室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = ______________ mol·L-1 c(H+) - c(MOH) = _______________ mol·L-1
⑵ 室温下如果取0.2mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),混合液中各离子浓度由大到小的顺序为
26.在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)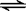 3Z(气),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
3Z(气),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入2 mol X和8 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y, mol Z,才能使平衡时Z为0.9a mol。
25.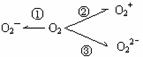 (1)据报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制成了新型的氧分子O4 ,它的结构很复杂,可能具有与S4相似的长方形结构,
(1)据报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制成了新型的氧分子O4 ,它的结构很复杂,可能具有与S4相似的长方形结构,
下列有关O4的说法不正确的是
A.O4与O3、O2都是氧的同素异形体 B.O4分子内存在极性键
C.合成O4的反应可看作核聚变反应,即不属于化学变化
D.O4的能量比普通氧分子高,将来可用作更强力的火箭推进的氧化剂
(2)制备O2-、O22-、O2+的化合物是可能的,它们通常是在氧分子进行下列反应时生成的(如上图)。在这些反应中(填序号.下同) 相当于氧分子的氧化, 相当于氧分子的还原。
(3)各写出一种含有O2-、O22-的物质的化学式: 、
24.在一个固定容积的密闭容器中充入2molNO2,一定温度下建立如下平衡:2NO2  N2O4
N2O4
此时平衡混合气中NO2的体积分数为X%,若再充入1molN2O4在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为Y%,则X和Y的大小关系正确的是
A.X>Y B.X<Y C.X=Y D.不能确定
23.若NA为阿伏加德罗常数,下列说法中正确的是
A.常温常压下,11.2LN2和NO的混合气体所含的原子数为NA
B.1 mol C8H18分子中,共价键总数为25NA C.在1molSiO2晶体中含 Si-O键的数目为2NA
D.含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数为0.2NA
22.国家食品药品监督管理局今年通报了查处齐齐哈尔第二制药有限公司假药案的最新进展情况:齐二药违反有关规定,将“二甘醇”辅料用于“亮菌甲素注射液”生产,导致多人肾功能急性衰竭。齐二药购入的药用辅料“丙二醇”实际为“二甘醇”。“二甘醇”在病人体内氧化成草酸,导致肾功能急性衰竭。又知“二甘醇(Diethylene glycol)”又称乙二醇醚或二乙二醇醚。下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物 B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸 D.分离“丙二醇”和“二甘醇”可采用分液的方法
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com