
题目列表(包括答案和解析)
28.将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为V1(V1≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成V2体积的CO2(V1、V2)均为标准状况的体积)。若2 V1=V2,则原混合中NaOH和NaHCO3的物质的量之比为
27.已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。 试回答下列问题:
(1)G的化学式为:_______________。
 (2)写出下列反应的化学方程式
(2)写出下列反应的化学方程式
①______________________________ ____
②________________________________ _。(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比 为3∶8,则X的化学式为:_____________;X与盐酸反应的化学方程式为:
___________________________________ __。
26.在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:________ (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质.
(2)现提供以下试剂: A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液.根据所学知识判断,___________同学(填甲或乙)的推断是正确的口用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
25.A是氮、氢两种元素组成的化合物,它与过氧化氢和水之间在结构上的关系相似。A分子中氮、氢的质量比为7:1。请填写以下空白。
(1)A的化学式是____________
(2)A的水溶液呈 (填“酸”、“碱”、“中”)性,1molA最多可与_____molHCl(或NaOH)发生中和反应形成正盐,写出形成的盐中含有氮原子的离子的电子式:_____________
(3)A在氧化还原反应中也与过氧化氢相似,既可作氧化剂,又可作还原剂,请根据价态分析产生这种情况的原因:
23.某溶液中含有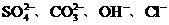 ,若只允许取一次该溶液而把四种离子分别检验出来,则应采取什么样的措施(能写出离子方程式的,写出每检出一种后的离子反应方程式,不能写的用“-”表示)。
,若只允许取一次该溶液而把四种离子分别检验出来,则应采取什么样的措施(能写出离子方程式的,写出每检出一种后的离子反应方程式,不能写的用“-”表示)。
(1)先检验______,加入___________试剂(或溶液),离子方程式为_____ ______ __
(2)然后检验______;加入_________试剂(或溶液),离子方程式为___ _____ __
(3)再检验_________;加入____ ___试剂(或溶液),离子方程式为_____________ __
(4)最后检验______;加入____ ___试剂(或溶液),离子方程式为_________ ______
24(1)向 溶液中,逐滴加入
溶液中,逐滴加入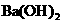 溶液至中性,写出发生反应的离子方程式:
_______________________________________
_.
溶液至中性,写出发生反应的离子方程式:
_______________________________________
_.
在以上中性溶液中,继续滴加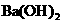 溶液,写出此步反应的离子方程式:
溶液,写出此步反应的离子方程式:
______________________________________ _.
(2)向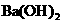 溶液中,逐滴加入
溶液中,逐滴加入 溶液至恰好不再生成沉淀为止,写出反应的离子方程式:
_____________________________________
___.
溶液至恰好不再生成沉淀为止,写出反应的离子方程式:
_____________________________________
___.
在以上溶液中,继续滴加 溶液,写出此步反应的离子方程式:
溶液,写出此步反应的离子方程式:
(3)向Ba(OH)2溶液中,逐滴加入明矾溶液至溶液中Ba2+恰好完全沉淀,其反应的离子方程式为: ______________________________________ __.
在上述溶液中,继续滴加明矾溶液,请写出此步反应的离子方程式:__________________ ____.
22.( )某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡但溴水的颜色逐渐褪去;③将镁粉放入液溴中,未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应 B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到 D.镁粉在水的催化下与溴发生反应
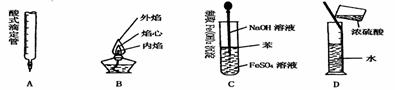
21.( )下列对实验仪器名称的标注或实验操作,正确的是
20.( ) 若原子序数为 116 号元素, 其元素最外层电子数为 6, 则下列叙述不正确的是:
A. X 是金属元素 B. X的钠盐的化学式为: Na2X
C. X的最高价氧化物的化学式为: XO3 D. X的最高价氧化物的水化物为碱
19.( )NA为阿伏加德罗常数,下述叙述中正确的是:
A.标准状况下,11.2L四氯化碳所含分子数为0.5 NA B.31g白磷含有3NA个共价键
C.60g SiO2与足量纯碱反应,高温下最多可释放出NA个气体分子
D.58.5g氯化钠中含有6.02×1023个氯化钠分子
18.( )下列离子方程式中正确的是:
A.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O B.Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓
C.向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.Na2S溶液呈碱性:S2-+H2O=HS-+OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com