
题目列表(包括答案和解析)
6.2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160 kJ·mol-1,而N≡N的键能为942 kJ·mol-1(键能表示形成化学键释放的能量或者破坏化学键消耗的能量)。则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3
D.用作炸药或高能材料可能是高聚氮潜在的应用
7用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.4 g重水(D2O)中所含质子数为0.2 NA
B.4.48 L N2与CO的混合物所含分子数为0.2 NA
C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2 NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
5.居室装修用石材的放射性常用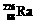 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A.一个 原子中含有138个中子
原子中含有138个中子
B.Ra元素位于元素周期表中第六周期ⅡA族
C.RaCl2的熔点比CaCl2高
D.Ra(OH)2是一种两性氢氧化物
4.下列物质提纯的方法正确的是
A.除去混在NO2中的NO:将气体与过量O2混合
B.除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.除去乙酸中混有的乙醇:向混合液中加入生石灰后蒸馏
3.下列关于硅和二氧化硅的叙述不正确的是
A. 晶体硅和二氧化硅晶体的结构都类似于金刚石
B. 晶体硅和二氧化硅晶体都常用来制造电子部件
C. 硅和二氧化硅都不与酸(氢氟酸除外)反应
D. 硅和二氧化硅都广泛存在于自然界中,天然单质硅叫硅石
2.下列有关物质的结构或性质的叙述错误的是
A.由极性键形成的分子不一定是极性分子
B.水是一种非常稳定的化合物,这是由于氢键所致
C.石英、食盐、金属钠、干冰的熔点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
1.旨在限制发达国家温室气体排放量、抑制全球范围内气候持续变暖的《京都议定书》随着俄罗斯的加入,将于2005年2月16日正式生效。我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,下列措施不切实际的是
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳能源 D.提高能源利用率
29.(18分)I,(6分).(1)在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平 中,标有“0”刻度的是(填序号,下同)__________________;标有使用温度的仪器是____________。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器 ①试管、②分液漏斗、③细口试剂瓶、④广口试剂瓶、⑤集气瓶、⑥滴瓶、⑦酸式滴定管、⑧碱式滴定管 中,没用到“磨砂”的有__________________。
II,(12分). 海水的综合利用可以制备金属镁,其流程如下图所示:
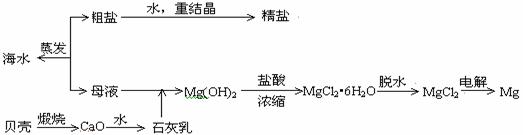
(1)实验时将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到的玻璃仪器是___________,说明在蒸发时使用该玻璃仪器的目的____________________________________________。
(2) 若在空气中加热MgCl2•6H2O,生成的是Mg(OH)Cl或MgO,请写出生成Mg(OH)Cl的化学方程式
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2•6H2O时,能得到无水MgCl2,其原因是 _______________________________
(3)由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
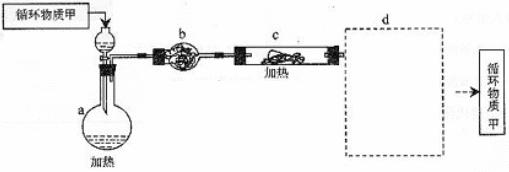
① 循环物质甲的名称是 b装置的仪器名称是_____________________
② 装置b中填充的物质可能是 (填入编号)
e 硅胶 f. 碱石灰 g. 无水氯化钙 h. 浓硫酸
③设计d装置要注意防止倒吸,请在方框中画出简图,并要求与装置c的出口处相连(铁架台不必画出)。
28.(14分)已知: CH3-CH=CH2 + HBr → CH3-CHBr-CH3
1mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A 在不同条件下能发生下图所示的一系列变化。
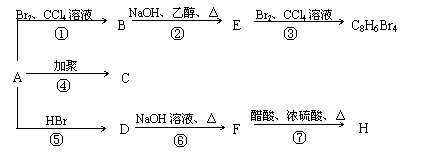
(1)A的化学式: A的结构简式:
(2)上述反应中,①是 反应,⑦是 反应。(填反应类别)
(3)写出C、D、E、H物质的结构简式:
C , D ,
E , H 。
(4)写出D → F反应的化学方程式
27.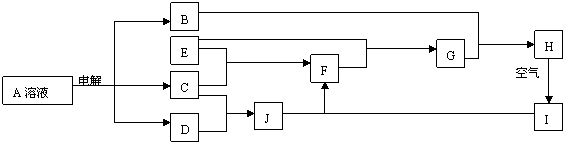 (16分)A、B、C、D、E、F、G、H、I、J均为中学化学中常见物质,其相互转化的关系如下所示:已知,A的焰色反应呈黄色,I是一种红褐色沉淀。
(16分)A、B、C、D、E、F、G、H、I、J均为中学化学中常见物质,其相互转化的关系如下所示:已知,A的焰色反应呈黄色,I是一种红褐色沉淀。
⑴写出下列物质的化学式:B:NaOH ;E:Fe ;D: H ;H: Fe(OH) 。
⑵常温下C是黄绿色气体:
①写出A的电极反应方程式:阴极: 2H++2e-=H↑(或2HO+2e-=H↑+2OH-) ;
阳极: 2Br--2e -=Br ;
②写出H→I的化学方程式:4Fe(OH)+O+2HO=4Fe(OH) ↓;
③G与足量Cl2反应的离子方程式:2Fe2++4Br-+3Cl=2Fe3++2Br+6Cl- 。
26.(12分)A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子外最外层电子数是次外层电子数的2倍。C元素是地壳是含量最多的元素。D是短周期元素中金属性最强的元素。E与F的位置相邻,F的最高价氧化物的水化物为最强酸。
(1)推断B的元素周期表中的位置:第 周期,
族。
(2)画出F的原子结构示意图: 。
(3)C、D可形成淡黄色的粉末,其电子式为: 。
(4)写出A与C形成的10电子微粒的化学式: 、 、
。
(5)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:
(从大到小排列) 。
(6)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热,写出反应的热化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com