
题目列表(包括答案和解析)
6.下列离子方程式表示正确的是
A.AgNO3 溶液中加入Cu :Cu+Ag+=Cu2++Ag
B.NaHCO3溶液中加入CH3COOH:
CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
C.0.1mol FeBr2 溶液中通入足量Cl2 :
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
HCO3-+Ba2++OH-=BaCO3↓+H2O
5.已知下列热化学反应方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = -24.8kJ/mol
Fe2O3(s)+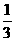 CO(g) =
CO(g) = 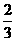 Fe3O4(s)+
Fe3O4(s)+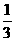 CO2(g) △H = -15.73kJ/mol
CO2(g) △H = -15.73kJ/mol
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H = +640.4kJ/mol
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为
A.-218kJ/mol B.-109kJ/mol C.+218kJ/mol D.+109kJ/mol
4.高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂。工业上可先制得高铁酸钠(离子反应为2Fe(OH)3 +3C1O-+ 4OH-= 2FeO42-+ 3Cl- + 5H2O),然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾。下列说法不正确的是
A.高铁酸钠溶解度比高铁酸钾大
B.每生成l mol Na2FeO4,转移3 mol电子
C.高铁酸钾不仅能消毒杀菌,还能除去水中的还原性杂质
D.高铁酸钾溶液是胶体,能吸附水中的悬浮杂质
3.为提纯下列物质(括号内为含少量的杂质),选用的除杂试剂和分离方法都正确的是
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
硝酸钾(NH4NO3) |
水 |
结晶 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
甲烷(C2H4) |
溴水 |
洗气 |
|
D |
苯(C6H5OH) |
浓溴水 |
分液 |
2.依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是
A.依据元素的原子序数,推断该元素原子的核外电子数
B.依据物质相对分子质量,推断物质熔、沸点的高低
C.依据气体的摩尔质量,推断相同状态下不同气体密度的大小
D.依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性
1. 2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他揭示了真核生物体内的细胞如何利用基因内存储的信息生产蛋白质。下列关于蛋白质的说法中正确的是
2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他揭示了真核生物体内的细胞如何利用基因内存储的信息生产蛋白质。下列关于蛋白质的说法中正确的是
A.蛋白质均为天然有机高分子化合物,没有蛋白质就没有生命
B.蛋白质均易溶于水,均能跟浓硝酸作用变黄
C.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
D.可以采用多次盐析或多次渗析的方法分离提纯蛋白质
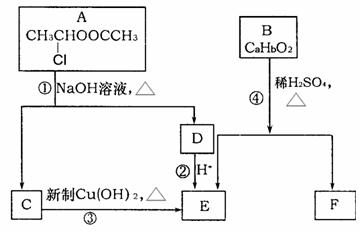
已知:一个碳原子上连有两个羟基时,易发生下列转化:

(1)E中含有的官能团是 。
(2)反应③的化学方程式为
。
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n (H2O)=2:1,则B的分子式为 。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种结构,写出其中一种的结构简式 。
29.(10分)短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个未成对电子。
(1)C原子的电子排布式为 ,若A为非金属元素,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第 周期 族,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
27. (10分)聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:


 乙烯
甲
乙
PVC
乙烯
甲
乙
PVC
(1)乙是PVC的单体,其结构简式为 ;
(2)反应③的化学方程式为
;
(3)写出以下反应类型:反应① ;反应② 。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸

是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP
(分子式为C10H10O4),DMP属于芳香酯,其结构简式为 。
26.(10分)聚合硫酸铁硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取PFS,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。生产步骤如下:
 (1)步骤I能否用HCl代替H2SO4 ?
(填“能”或“不能”)。
(1)步骤I能否用HCl代替H2SO4 ?
(填“能”或“不能”)。
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(3)步骤III所用的还原剂是 。
(4)步骤IV用NaClO3或 HNO3氧化时反应方程式(注意均未配平)如下:
FeSO4 + NaClO3 + H2SO4 → Fe2(SO4)3 + NaCl + H2O
FeSO4 + HNO3 + H2SO4 → Fe2(SO4)3 + NO↑ + H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊是 。
(5)产品PFS溶液中SO42-与Fe3+物质的量之比不是3:2。步骤V先加入NaOH溶液和 BaCl2溶液,目的是测定产品中SO42-与Fe3+物质的量之比。测定时需要称量 和 的质量。
25.(10分)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol SO2和1mol
O2,乙中充入2mol SO3和1molHe,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
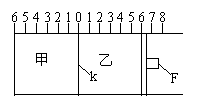
(1)可根据 现象来判断甲、乙都已达到平衡。
(2)达到平衡后隔板K是否可能处于0刻度 (填“可能或不可能”)。若K最终停留在0刻度左侧a处,则a一定小于 。
(3)若平衡时,K最终停留在左侧刻度1处,则甲中 SO3的物质的量为 mol,乙中SO3的转化率 50%(填:>、<、=)。此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号:① <6 ② >6 ③ =6)。
(4)若一开始就将K、F固定,其它条件均不变,则平衡时,甲、乙中SO3的物质的量分数是甲 乙(填:>、<、=);测得甲中SO2的转化率为w%,则乙中SO3的转化率等于 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com