
题目列表(包括答案和解析)
25. (10 分) 向物质的量之和为0.1mol 的FeCl3和AlCl3混合溶液中加入90mL4mol· L-1的NaOH 溶液,使其充分反应。 假设原溶液中Al3+ 物质的量与Al3+ 和Fe3+ 总物质的量之比为x,(不考虑Fe3+ 和Al3+的水解情况) 。求:
(1)当x=0.8 时,溶液中产生的沉淀是什么?其物质的量为多少?
(2) 当沉淀只有 Fe(OH)3 时,计算x的取值范围.
(3)请在图中画出沉淀总量 n/mol 随 x (0~1)变化的曲线
24.(8分)含氮废水进入水体而对环境造成的污染越来越严重,某化学兴趣小组的同学经过查阅资料,发现两条消除污染的途径:
(1)用金属镁将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:2NO3-+ 5Mg + 6H2O = N2↑+ 5Mg(OH)2↓ +2OH-。金属镁是从海水中提取MgCl2,然后再通过电解制得。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水多少kg?
(2)甲醇加入含NO3-的废水中也可消除氮的污染,在微生物作用下NO3-和CH3OH 均转化为无毒气体和水,请写出该反应的离子方程式。若某废水用上述方法处理时, NO3-→N2的转化率为a%,那么每天处理此含NO3-为b g/L的废水V m3 (密度1g/cm3) 。需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
23.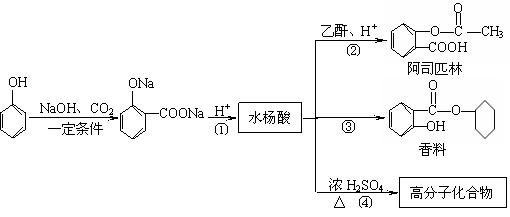 (10分)苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
(10分)苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
回答下列问题:
⑴ 在反应①-④中属取代反应的是________________。
⑵ 写出反应④的化学方程式________________________________________________。
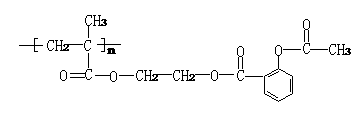 ⑶ 把阿司匹林分子连接在某高分子化合物上,便可形成结构如下的缓释长效药剂:
⑶ 把阿司匹林分子连接在某高分子化合物上,便可形成结构如下的缓释长效药剂:
长效阿斯匹林完全水解后生成的有机物有 种。
⑷ 甲苯也可用来合成水杨酸。请设计合理方案由甲苯合成水杨酸(用反应流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:

 A B
……
A B
……
22.(8分)充分燃烧含C、H、O的一类有机物,相同条件下,消耗 O2 的体积与生成 CO2 的体积之比为9∶8。
(1)该类有机物最简式是 (填字母)
A.Cn(H2O)m B.(C2H3)n(H2O)m C.(C2H)n(H2O)m D.(CO)n(H2O)m(2)若符合该化合物通式的某有机物的分子量为136,则其分子式为
。若该有机物属于酯类且分子含有苯环,则其同分异构体除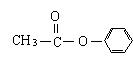 、
、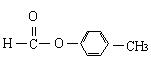 外,还有:
、
、
外,还有:
、
、
、 。
21.(10分)近年来,镁在汽车、航天、航空、机械制造、军事等产业中应用迅猛发展。
 ⑴新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,是由于镁合金具有
等优异性能。
⑴新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,是由于镁合金具有
等优异性能。
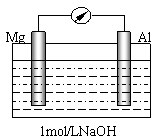
⑵某研究性学习小组探究以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池(如右图所示)时发现,刚开始,电表指针向右偏转,镁条做负极;但随后很快指针向左偏转,镁条表面有极少量的气泡产生。
①开始阶段,负极发生的反应是 。
②随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-=H2↑+2OH-,试写出镁电极发生的主要反应的极反应式______________________。
⑶经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如右图所示,溶液中的产物有Mg(NO3)2,NH4NO3和H2O。某同学拟用1.2g镁与100mL硝酸反应制取二氧化氮,硝酸的物质的量物质的量浓度至少为 。
20.(10分)由短周期元素组成的10种物质A-J间有下图所示的转化关系。已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成。试回答:
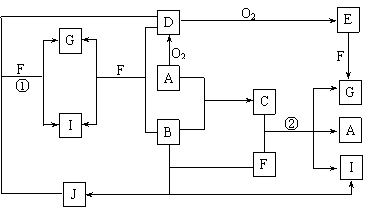
⑴工业生产中实现“D+O2 → E”转化的设备是 。
⑵反应①的离子方程式为 。
⑶足量铁与G的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g液态F吸收49gE气体生成液态G时放出热量65.15kJ,则表示该反应的热化学方程式为 。
⑸C是一种重要的化工产品,为易挥发樱桃红色液体。若反应②中G和A的物质的量之比为1∶2,则C的电子式为 。
19.(8分)已知A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的2/3倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z。请回答下列问题:
(1)B、D两元素的名称分别是 、 。
(2)化合物B2A2的电子式为 。
(3)Y与C的最高正价氧化物的水化物刚好完全反应时,其生成物的水溶液呈 性(填“酸”“碱”或“中”),其原因是(用离子方程式表示) 。
(4)在(3)所得生成物的水溶液中,存在着如下关系,用粒子浓度符号填写:
① c(H+)+ =c(OH-)+ ;
② c(H+)= c(OH-)+ 。
(5)用X、D2、NaOH溶液和惰性电极,可设计为一种燃料电池。则该燃料电池的
负极反应为 ;
正极反应为 。
18.(12分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:


有关物质在水中溶解度分别为:
氯化铵:10℃时33.3 g、20℃时37.2 g、30℃时41.4g;氟化钠:20℃时4 g;氟硅酸钠微溶于水。
请回答下列问题:
⑴ 上述流程中发生两步化学反应,第一步反应的化学方程式为: ,
第二步反应能进行是因为 。
⑵ 操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有 。
⑶ 操作II的作用是 。
⑷ 操作Ⅲ的具体过程是 。
⑸ 流程中NH4HCO3必须过量,其原因是 。
4.18J/(g·℃),溶液的密度约为1.0g·cm-3。
①计算实验所测得△H = KJ·mol-1,
(保留一位小数)
②CH3COOH的中和热的文献值为56.1KJ· mol-1,排除实验操
作所产生的误差,请你分析实验测得值产生偏差的可能原因
。
17.(10分)(1)玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般不需要使用玻璃棒进行操作的是(填字母代号)
_____。
A.配制一定溶质质量分数的溶液
B.用pH试纸测定NH4Cl溶液的pH
C.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
D.实验室用FeSO4溶液和NaOH溶液制备Fe(OH)2沉淀
E.用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
F.硫酸铜晶体里结晶水含量测定的实验
G.将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
H.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
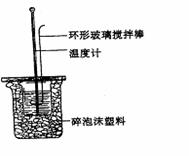 I.探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
I.探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
(2)在如图装置中,将50mL0.50 mol ·L-1的CH3COOH
溶液与50mL0.55 mol ·L-1的NaOH 溶液混合,温度从25.0℃
升高到27.8℃。已知0.25 mol·L-1CH3COONa溶液的比热容为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com