
题目列表(包括答案和解析)
24.(5分)某混合气体由两种气态烃组成。取2.24L该混合气体完全燃烧后,得到4.48L二氧化碳和3.6g水。(上述气体体积,都已折算为标准状况下的数据)
试通过计算,确定混合气体中两种烃可能组成。
23、(10分)(Ⅰ)已知烯醇式的结构不稳定,易发生如下转化:
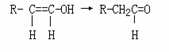
下图有机物A到G的转化关系。其中E能与NaOH 溶液反应,G能使Br2的CCl4溶液褪色,反应③中,只生成一种结构的有机物。回答下列问题:
(1)写出A和G的结构简式
A: ;G: 。
(2)指出①、③反应的类型①: ;③ 。
(3)写出②、③步反应的化学方程式
② 。
③ 。
(Ⅱ)分子式为C13H28O的饱和一元醇,既不能发生消去反应,也不能在一定条件下与O2发生催化氧化,则该醇的结构简式为
22、(8分)现有饱和一元醇的混合物和饱和一元羧酸的混合物在一定条件下反应生成多种酯的混合物,酯的相对分子质量分别为M1、M2、M3,并依次增加14。经分析,相对分子质量为M2的酯有三种,其氧元素所占的质量分数为31.4%。请回答:
⑴相对分子质量为M2的酯的化学式为 。
⑵饱和一元羧酸的化学式分别为_ __、__ __、__ _,(不必填满)参加反应的对应的醇结构简式为_ ___、_ __、__ _、(不必填满)。
⑶与相对分子质量为M1的酯互为同分异构体,能发生银镜反应、能与金属钠反应产生氢气的有机物的同分异构体有 种。
21、(8分)(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。已知在101kpa,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624KJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20-30%的KOH溶液。
肼-空气燃料电池放电时,正极的电极反应式是
 (3)下图是一个电化学过程示意图。
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应式是 ;
②假设使用肼-空气燃料电池作为本过程的电源,铜片质量变化128g,则肼-空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法是以NaClO氧化NH3制得肼的稀溶液。该反应的离子方程式是
。
20、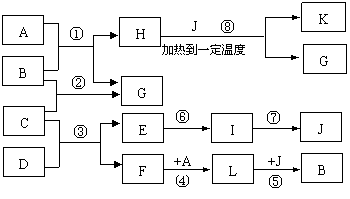 (10分)已知A是常见气体,K是石油化学工业的重要的基础原料,是一种植物生长调节剂,G是一无色液体,D、E、I、J四种物质中含同一种元素。图中一些反应条件和产物已省去。
(10分)已知A是常见气体,K是石油化学工业的重要的基础原料,是一种植物生长调节剂,G是一无色液体,D、E、I、J四种物质中含同一种元素。图中一些反应条件和产物已省去。
(1)工业上反应③在 中进行,反应⑦在 (均填工业设备名称)中进行。反应⑥的条件是 。
(2)除反应③、⑦外,还有 反应是工业反应。(填数字序号)
(3)反应①的化学方程式是 。
反应③的化学方程式是 。
反应⑧的化学方程式是 。
19.(8分)回答下列问题:⑴ 常温下将体积为v1、浓度为c1的一元弱酸与体积为v2、浓度为c2的一元弱碱混合。若v1·c1=v2·c2,混合后的溶液pH<7,则一元弱酸的电离程度 (选填“大于”、“小于”或“等于”)一元弱碱的电离程度;
⑵ 对于一定条件下体积可变的密闭容器中已达平衡的可逆反应:
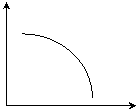 A(g)+3B(g)
A(g)+3B(g)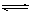 2C(g);ΔH<0
2C(g);ΔH<0
若其他条件不变,只改变右图中横坐标所表示的物理量,纵坐
标所表示的物理量变化如右图所示:
① 若横坐标表示温度,则纵坐标可以表示 (至
少填两个含义不同的物理量);
② 若横坐标表示压强,则纵坐标 (填“能”或“不能”)表示平衡混合物的密度,理由是 。
18、(13分)某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了下图所示装置进行有关实验:
(1)先关闭活塞a,将6.4g铜片和12mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:
, ;
 ②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
③实验结束后,装置C中的溶液中可能含有的溶质有 ;
(2)事实表明,上述反应全部结束后,硫酸仍有剩余。为定量测定剩余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定剩余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请你写出其中的一种
;
②乙学生设计的方案是:将反应后的溶液冷却后全部移入100mL容量瓶中并加蒸馏水定容,取20ml于锥形瓶中,用酚酞作指示剂,用标准氢氧化钠溶液进行滴定,再求出余酸的物质的量的浓度。你认为乙学生设计的实验方案能否准确求得余酸的物质的量的浓度
(填“能”或“否”),理由是 。
17、(11分)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3 SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为
。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅱ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ。实验Ⅰ、Ⅱ产生的现象完全相同。由上述实验得出的结论是 。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② .
16、下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c(NH4Cl)<c[(NH4)2CO3]
B.在NaHS溶液中一定有:c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
C.已知H2B是二元酸.在0.1mol/L pH为4的NaHB溶液中:
c(HB-)>c(H2B)>c(B2-)
D.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(OH-)>c(H+)
15、关于有机物C3H6O3的下列叙述一定正确的是: ( )
A.若能与金属钠和碳酸氢钠反应,则其结构中同时含有-OH和-COOH
B.若该物质中含有两个-CH3,则它可以是碳酸酯
C.若该物质中所有原子所处的化学环境相同,则其结构中只有C-O键和C-H键,且为六元环结构
D.若1mol C3H6O3与足量钠反应只产生1mol氢气,说明一分子C3H6O3中含有2个-OH和一个-CHO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com