
题目列表(包括答案和解析)
6. 下列制取、检验、提纯或保存物质的方法可行的是
① 向某溶液中加入KSCN溶液检验该溶液是否含有Fe3+,② 用植物油、乙醇、NaOH溶液制取肥皂,③ 向FeCl3饱和溶液中滴加NaOH溶液制取Fe(OH)3胶体,④ 用焰色反应检验
K+时须透过蓝色钴玻璃观察,⑤ 液溴用水液封后密封保存在棕色试剂瓶中,⑥ 向混有乙酸的乙酸乙酯中加入NaOH溶液再分液,提纯乙酸乙酯。
A.①③⑤⑥ B. ①②④⑤ C.②④⑤⑥ D.①③④⑥
5. 下列工业生产的说法错误的是
A.氯碱工业中隔离两电极的材料是阳离子交换膜,因此该生产方法又称“阳离子交换膜法”B.生产普通玻璃的主要原料及设备:石灰石、石英、纯碱及玻璃熔炉
C.由于常压下SO2转化为SO3的转化率很高,所以SO2接触氧化时不采用高压的反应条件
D.合成氨的反应是放热反应,因此工业上合成氨常采用低温条件
4. 下列说法或表示方法正确的是
A.反应物总能量低于生成物总能量时,该反应不能发生
B.中和热一定是强酸跟强碱反应放出的热量
C.由石墨比金刚石稳定,可知C(石墨)→ C(金刚石);ΔH>0
D.在101 kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热
化学方程式表示为:2H2(g) + O2(g) == 2H2O(l);ΔH=-285.8 kJ/ mol
3. 实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A.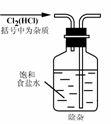 B.
B.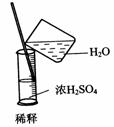
C.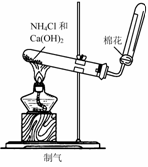 D.
D.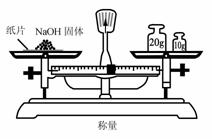
2. 正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
A.H、D、T互为同素异形体 B.氨气分子构型为正四面体形
C.NH4Cl的电子式为: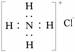 D.S2-的结构示意图为:
D.S2-的结构示意图为: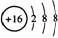
1. 化学与科技、社会、生产密切结合,下列有关说法不正确的是
A.“乙醇汽油”的广泛使用能有效减少有害气体的排放
B.“无磷洗涤剂”的推广使用,能有效减少水体富营养化的发生
C.“无氟冰箱”取代“含氟冰箱”,对人类的保护伞--臭氧层起到保护作用
D.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
24蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1) 若此蓄电池放电时,该电池某一电极发生还原反应的物质是 (填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2) 假如用此蓄电池分别用来电解以下两种溶液,工作一段时间后都分别消耗0.36g水,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一极增加了ag M,则金属M的相对原子质量的计算式为
(用“a、x表示)。
②电解含有0.01molCuSO4和0.0lmolNaCl的混合溶液l00mL,阳极产生标准状况气体 L;将电解后溶液加水稀释至1 L,此时溶液的pH=
25(9分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
I.⑴某同学根据数据推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的推测是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________。
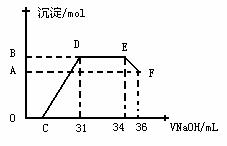 II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
⑴图中OC段没有沉淀生成,此阶段
发生反应的离子方程式为 。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ;
⑶B与A的差值为 mol。
⑷B点对应沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL
21.21世纪80年代日本科学家应用电子计算机模拟出结构类似于
C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,
N60与C60有相似的结构但稳定性较差。科学家预测,将
N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,
该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
已知E(N-N)=167kJ·mol-1,E(N=N)=418kJ·mol-1,E(N≡N)=942kJ·mol-1。(E表示键能,即打开1mol气态化学键所需要的能量)
回答下列问题:
⑴ N60分子中每个N原子最外层有 个电子;
⑵ N60稳定性较差的原因可能是 ;
⑶ 1molN60受热分解为N2时放出的热量为 ;
(4)N60潜在的商业用途可能是 六、(本题包括2小题,共18分)
22利胆解痉药“亮菌甲素”跟(CH3)2SO4反应生成A。二者的结构简式如图。

试回答:
(1)“亮菌甲素”的分子式为 ,1mol“亮菌甲素”跟浓溴水反应时最多消耗 mol Br2;A不能发生的化学反应有 。
(2)有机物A能发生如下转化。
提示:
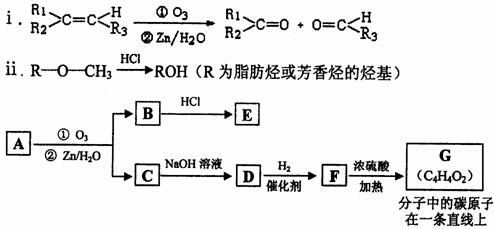
①C→D的化学方程式为 。
②1 mol G跟1 mol H2在一定条件下反应,生在物的结构简式为 。
③符合下列条件的E的同分异构体有 种,写出其中任意一种的结构简式。
a.遇FeCl3溶液呈紫色
b.不能发生水解反应,能发生银镜反应
c.苯环上的一氯取代物只有一种,分子中无甲基
23一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。G的分子式为C7H14O2。有关转化关系如下;
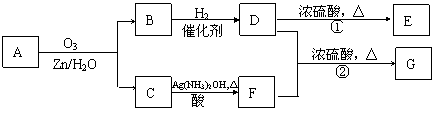
(1)B的相对分子质量是__________________。
(2)写出结构简式:A__________________、E_______________________。
(3)写出反应①、②的反应类型:①________________、②_______________。
(4)写出反应②的化学方程式:__________________________________________。
(5)F的一种同分异构体能发生酯化反应和银镜反应,写出该物质银镜反应的化学方程式:
19.A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
⑴C、D组成的常见化合物,其水溶液呈碱性,原因是 ____________(用离子方程式表示)。写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式 ___________。
⑵D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式:
_ ________________________。
⑶A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
 20右图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)
20右图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)
已知,F可用作化肥也可用来作炸药,G可用于建筑工程上的抗冻剂和防腐剂。据此回答下列问题。
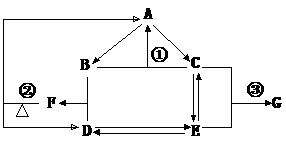
(1)写出反应①的化学方程式 并指出该反应在现代工业上的重要意义:
(2)物质B的分子空间构型为
(3)已知反应②是氧化还原反应,其氧化产物与还原产物的质量比为
(4)写出反应③的离子方程式
18..用Na2SO3和硫粉在水溶液中加热反应可以制得Na2S2O3。10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60g和212g,常温下,从溶液中析出晶体是Na2S2O3·5H2O 。Na2S2O3在酸性溶液中立即完全分解:Na2S2O3+2HCl = S↓+ SO2↑+H2O + 2NaCl。现取15.1g Na2SO3溶于80mL水,另取5.00g硫粉,用少量乙醇润湿后(以便硫能被水浸润),加到上述溶液中,用小火加热至微沸。反应约为1h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
(1)若加入的硫粉不用乙醇润湿,对反应的影响是
A.会降低反应速度 B.需要提反应温度
C.将增大体系的pH D.会减少产量
(2)反应1h后过滤,其目的是 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。它是由 而产生。
(4)设Na2SO3与S完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30 mL。该溶液是否达到饱和?试通过计算说明(70℃时Na2S2O3饱和溶液的密度为1.17 g·cm-3)。
(5)若要计算在100℃下将溶液蒸发至体积为30mL,再冷却至10℃时所得到的Na2S2O3·5H2O的质量,你认为
A.前面提供的数据已足够
B.还要提供100℃时溶液的密度为1。14g·cm-3
C.还需要提供结晶后剩余溶液的体积
(6)根据第(5)小题你选择(如选A则直接计算,如选B或C则可选用其数据),计算从10℃、30mL溶液中结晶而出的 Na2S2O3·5H2O的质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com