
题目列表(包括答案和解析)
21.(14分)实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)====Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
(1)这些装置的连接顺序(按气体左右的方向)是
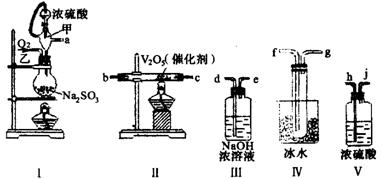
_____________→_______________→______________→_______________→_______________→_______________→_______________→_____________(填各接口的编号)。
(2)实验时甲仪器的作用与原理是
______________________________________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时I处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是______________________________________________________________。
(4)Ⅳ处观察到的现象是______________________________________________________。
(5)在I处用大火加热烧瓶时,SO2的转化率会_______________(填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为____________________________。
20.下列物质有固定熔点的是( )
A.玻璃 B.过磷酸钙 C.水晶 D.水玻璃
19.某元素R的最高价氧化物化学式为R2O5,在R的气态氢化物中含H 3.85%,则R的相对原子质量约为( )
A.75 B.51 C.31 D.14
18.甲、乙、丙、丁4种溶液,在热的Ba(OH)2溶液中加入甲,有气体产生,再加入乙,有白色沉淀生成,在沉淀中加入丙,沉淀溶解,再加入丁,又产生白色沉淀。则甲、乙、丙、丁依次是( )
A.Na2CO3、NH4Cl、HCl、CaCl2
B.NH4NO3、K2CO3、HCl、MgSO4
C.(NH4)2SO4、H2SO4、Na2CO3、HCl
D.NH4NO3、Na2CO3、H2SO4、KCl
17.某溶液滴入氯化钡溶液后产生白色沉淀,再加入稀硝酸后沉淀不溶解,则溶液中( )
A.一定含有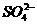
B.一定含有Ag+
C.一定含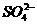 和Ag+
和Ag+
D.可能含有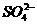 或Ag+
或Ag+
16.在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是:0.4 mo1·L-1、0.1 mol·L-1。向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol·L-1)是 ( )
A.0.15 B.0.225 C.0.35 D.0.45
15.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.x+2 B.x+4 C.x+8 D.x+18
14.下列说法正确的是( )
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃中可以得到原硅酸
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸
13.下列反应中,既能表现出硝酸的酸性,又能表现出其氧化性的是( )
A.Fe2O3+HNO3 B.Al(OH)3+HNO3
03(浓) D.FeO+HNO3
12.限用一种试剂,经过一次性实验就能鉴别Na2CO3、(NH4)2SO4、NH4Cl、KNO3溶液,应选用( )
A.AgNO3溶液 B.NaOH溶液
C.Ba(OH)2溶液 D.盐酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com