
题目列表(包括答案和解析)
18.(10分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进形研究。
(1)提出假设:该反应的气体产物全部是二氧化碳。
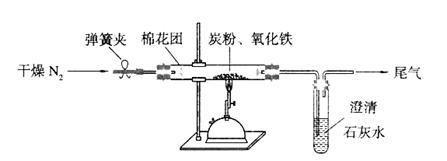 (2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:
。
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g氧元素为0.96g。得出原假设不成立,理由是 。
(6)得出结论:根据数据处理结果判断反应产生的气体是 ,
该实验中发生的化学方程式为 。
(7)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
17.(4分)(1)下列实验操作中,不正确的有 。
①用试管夹夹持试管时,试管夹从试管上部往下套,夹在试管的中上部
②将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
③硝酸、溴水可长期盛放在棕色的滴瓶中
④熔融氢氧化钠要在耐高温的石英坩埚中
⑤准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤压玻璃球,放溶液至21.00mL处
⑥检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置到充分沉淀后,取上层清液于试管中,滴加KSCN溶液2-3滴即可
(8分)(2)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42- 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
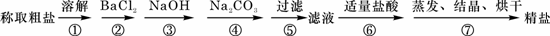
 (1)判断BaCl2已过量的方法是__________________________。
(1)判断BaCl2已过量的方法是__________________________。
(2)第④步中,相关的离子方程式是_____________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
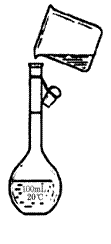
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是____________ __。
16.可逆反应aX(g)+bY(g) cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
( )
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
( )
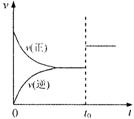 A.若a+b=c,则t0时只能是增大了容器的压强
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是加入了催化剂
D.若a+b≠c,则t0时只能是增大了容器的压强
第II卷 非选择题(共86分)
15.t℃时,将100g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5g晶体。再蒸发掉10g水,恢复至t℃,析出7.5g晶体。下列说法中不正确的是 ( )
A.t℃时原100g溶液是饱和溶液
B.若析出的晶体中不含结晶水,则可计算出t℃时A的溶解度
C.若析出的晶体中含有结晶水且已知晶体的化学式和相关元素的相对元素原子质量,就可以计算出t℃时A的溶解度
D.根据题给条件可以计算出原溶液溶质的质量分数
14.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是: ( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,SOCl2 被还原为Li2SO3
D.电池工作过程中,负极消耗锂与正极区析出的S的质量之比为7:8
13.下列离子方程式中正确的是: ( )
A.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
B.Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓
C.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.等体积等物质的量浓度的NaOH和NH4HSO4溶液混合:H+ + OH- = H2O
12.将某些化学知识用数轴表示,可以收到直观、简明、易记的效果。用数轴表示的下
列知识正确的是 ( )
A 硫及其化合物的化会价与氧化还原反应的关系.

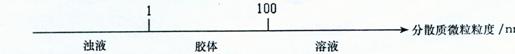 B。分散系的分类:
B。分散系的分类:
C.硫单质在02中燃烧后的产物:

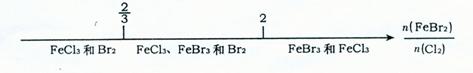
D.已知:还原性Fe2+>Br-,则FeBr2溶液与CI2反应的产物
11.化学实验室中常对溶液或试剂进行酸化,下列酸化处理中正确的是 ( )
A.检验C2H5Cl中的氯元素时,将C2H5Cl和NaOH溶液混合加热后,加稀硫酸酸化
B.鉴别溶液中SO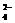 和CO32-时,所加的氯化钡溶液可以用盐酸酸化
和CO32-时,所加的氯化钡溶液可以用盐酸酸化
C.为提高高锰酸钾溶液的氧化能力,用浓盐酸将高锰酸钾溶液酸化
D.实验室在保存Fe2(SO4)3溶液时,通常滴加几滴稀硫酸酸化
10.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3- B.Na+、SO42-、Cl-、 ClO-
C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3-、Na+
9.下列说法正确的是 ( )
A.200 mL,1 mol/L Al2(SO4)3溶液中,Al3+ 和SO42-离子总数为6.02×1023
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C.30 g甲醛中含共用电子对总数为4×6.02×1023
D.0.1 mol 8135Br原子中含中子数为3.5×6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com