
题目列表(包括答案和解析)
13.下列指定微粒的个数比为2:1的是
A.SiO2晶体中Si-O键数与Si原子个数
B.金刚石晶体中的C-C键数与C原子个数
C.石墨晶体中,碳原子数与共用电子对数
D.BaO2(过氧化钡)固体中的阴离子和阳离子
12.下列各组离子,在下列条件下一定能大量共存的是 ( )
A.加入KSCN溶液变红的溶液中: Na+、K+、SO42-、HCO3-
B.加入铝粉能放出氢气的溶液中: CO32-、AlO2-、I-、NO3-
C.能使pH试纸变深蓝色的溶液中:Na+、SO32-、CO32-、SO42-
D. 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
11.下列事实,不能用勒夏特列原理解释的是
A.
溴水中有下列平衡Br2 + H2O HBr+HBrO,当加人少量AgN03 溶液后,溶液颜色变浅
B.对2HI(g)
HBr+HBrO,当加人少量AgN03 溶液后,溶液颜色变浅
B.对2HI(g) H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成NH3 反应,为提高NH3
的产率,理论上应采取低温度的措施
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成NH3 反应,为提高NH3
的产率,理论上应采取低温度的措施
10.在一定条件下,反应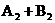
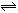
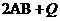 (表示热量)的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a为500℃,b为300℃时的情况(其他条件不变),c则为在时刻
(表示热量)的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a为500℃,b为300℃时的情况(其他条件不变),c则为在时刻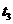 开始缩小容器容积(温度维持300℃)的情况,则Q的值应为( )
开始缩小容器容积(温度维持300℃)的情况,则Q的值应为( )
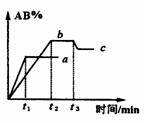
A.Q>0. B.Q<0. C.Q=0. D.无法判断
9.设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,11.2LCHCl3中含有的C-Cl键的数目为1.5NA
B.常温常压下,62g白磷分子中的共价键数约为2 NA
C.常温常压下,92gNO2和N2O4混合气体中含有的原子数为6NA
D.工业上电解精炼铜时,电解池中每转移1mol电子时,阳极上溶解的铜原子数为0.5 NA
8.下列离子方程式中正确的是
A.KMnO4与H2O2反应产生O2:2MnO4-+ H2O2+6H+==2Mn 2++3O2↑+4H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+ CO32-+2H2O
C.Na2CO3溶液中通入少量CO2: CO32-+ CO2+ H2O=2HCO3-
D.向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-
7.已知HF的酸性比HCN的酸性强。现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中的离子数目为n1,后者溶液中的离子数目为n2。下列关系正确的是( )
A.n1=n2 B.n1>n2 C.n1<n2 D.c(F-)<c(CN-)
6.关于某溶液中所含离子的推断,不正确的是
①加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl – 存在
②加入稀硝酸酸化后,加入BaCl2溶液,有白色沉淀,可确定有SO42- 存在
③加入BaCl2溶液,有白色沉淀,加盐酸或稀硝酸沉淀均不溶解,可确定有SO42- 存在
④加入盐酸,有能使澄清石灰水变浑浊的无味气体产生,可确定溶液中有CO32- 存在
A、①③④ B、②④ C、①②③ D、①②③④
5.某无色混合气体依次通过浓H2S04 和Na2O2,若气体体积不断减少,最后颜色变深,则原混合气体的成分可能是
A. H2、Cl2、H2S B. NH3、NO、CO2
C. NH3、N2、NO D. HCl、NO2、CO2
4.右图是制取和收集某气体的实验装置,该装置可用于
A.用浓硫酸和亚硫酸钠反应制取SO2
B.用过氧化钠固体和水反应制取O2
C.用浓硝酸与铜反应制取NO2
D.用浓氨水和生石灰反应制取NH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com