
题目列表(包括答案和解析)
23.(11分)下列各物质为中学化学中常见物质,其中A、C、E、F为气体,B、D为无色液体,D是一种重要的化工原料,反应⑥是实验室用于制备单质C的反应,X是一种黑色粉末,F、B分子具有相同的电子数。反应中部分生成物已略去。
 试回答下列问题:
试回答下列问题:
(1)B的电子式为:____________。
(2)在反应④、⑥中,X的作用分别为:__________、________。
(3)根据图中信息,B、C、D、X氧化性从强到弱的顺序是_________。(用对应物质的化学式表示)
(4)写出反应②的化学方程式:______________________。
(5)写出反应①、⑥的离子方程式:
①__________________;⑥______________________________。
22.(12分)下表中表示元素周期表的边界结构。①-⑤分别表示元素周期表中对应位置的元素。
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
③ |
④ |
⑤ |
|
|
|||||||||
|
① |
|
|
|
|
|
|
|
|
||||||||||
|
② |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)短周期元素甲的最外层电子数是两个内层电子数之差,则甲元素的元素符号为_____。
 (2)元素乙的M层电子数只有甲元素的一半,则乙原子半径与甲原子半径比较:________>________(用化学式表示,下同);甲、乙的最高价氧化物水化物的酸性强弱为:________>________。
(2)元素乙的M层电子数只有甲元素的一半,则乙原子半径与甲原子半径比较:________>________(用化学式表示,下同);甲、乙的最高价氧化物水化物的酸性强弱为:________>________。
(3)元素⑤的单质与元素④的氢化物反应的化学方程式为:_________________________,元素③氢化物的电子式为_______,元素④在与⑤形成化合物时,元素④化合物中显_____价。
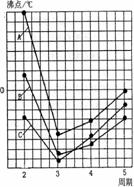
(4)右图中A、B、C三条曲线分别表示③、④、⑤三种元素所在主族元素的气态氢化物的沸点,其中表示元素④所在主族元素气态氢化物沸点的是曲线 ;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是 ;A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物沸点的原因是 。
21、(8分)次磷酸(H3PO2)是一种强还原性弱酸,它能发生下列反应:
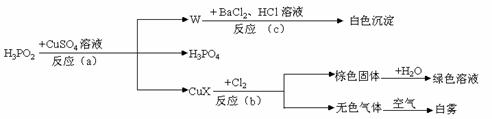
(1)CuX中X是表示一种元素,这种元素是 。
(2)反应(a)的化学方程式为 ,其中被氧化的元素是 ,还原产物是 (写物质的名称)。
(3)反应(c)的离子方程式为 。
(4)反应(b)中,当有1molCuX被氧化时,转移的电子数目为 个。
20. (13分)某校为了改进碳与浓硝酸反应的实验,设计了如图所示的装置,实验步骤:先预热盛有无水氯化钙的烧瓶,然后投入几小块红热的炭块,再缓缓向炭块上滴加浓硝酸(最好用发烟硝酸),反应即可连续发生。请完成下列空白:

(1)红热的炭块投入烧瓶中后先是由红变暗,滴入浓硝酸后又由暗变红,原因是_____________________,反应的化学方程式为__________________________________。
(2)烧瓶中的现象是_______________________________________________________;试管中的现象是____________________________________________________________。
(3)无水氯化钙的作用是______________________,水湿棉花的作用是____________,气球的作用是________________________。
(4)若在反应结束后,在试管中得到20g沉淀(假设各步反应均进行完全),若要使气球中所得气体完全被水吸收(4NO十3O2十2H2O=4HNO3),则需要再通入O2的体积为__________L(标准状况,装置中的空气在此处计算时,可忽略)。
19.(16分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶 于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,
写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)
。
18.(10分)(1)已知白磷的燃烧热为2378.0 kJ/mol,写出表示白磷的燃烧热的热化学方程式:_____________________________________________________。
(2)强酸强碱反应的中和热为:57.3kJ/mol,将1.00L、1mol/LH3PO4和1.00L、1mol/LNaOH溶液反应,放出的热量为Q1,则Q1______(填“大于”、“小于”、“等于”)57.3kJ,其原因是___________________________________________若再往溶液中加入1.00L、1mol/LNaOH溶液,完全反应后又放出热量为Q2,则Q1______(填“大于”、“小于”、“等于”)Q2。
(3)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H-I(g)+297kJ即H-I键的键能为297kJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297kJ的能量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。化学反应的能量变化(△H)与反应物和生成物的键能有关。下表是部分化学键的键能数据:

|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/ kJ·mol–1 |
197 |
360 |
499 |
X |
白磷完全燃烧的产物结构如图所示,则上表中X= 。
17.(6分)玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是(填字母代号)____________。
A、一定溶质质量分数溶液的配制
B、用适量的蔗糖、浓硫酸和水在小烧怀中进行浓硫酸的脱水性实验
C、用普通漏斗组成的过滤装置进行过滤实验
D、用浓氨水和浓盐酸进行氨和氯化氢反应的实验
E、用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
F、硫酸铜晶体里结晶水含量测定的实验
G、将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
16.Cu、Cu2O和CuO组成的混合物,加入100mL0.6mol∙L-1HNO3溶液恰好使混合物溶解,同时收集到224mLNO气体(标准状况)。则混合物中的CuO的物质的量可能为:
A.0.005mol B.0.0075mol C.0.015mol D.0.020mol
第Ⅱ卷(非选择题 共76分)
15.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是
A.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
B.放电时,Li是电池的负极,LiMn2O4发生氧化反应
C.充电时,LiMn2O4发生氧化反应
D.充电时,电源的正极与电池的C电极相连
14.工业上进行下列物质的制取,其所示的物质的转化关系中,正确的是
A.以食盐为原料制Na2CO3:
2NaCl+2H2O2NaOH+H2↑+Cl2↑, 2NaOH+CO2=Na2CO3+H2O
B.以黄铁矿和空气为原料制取硫酸:
4FeS2+11O22Fe2O3 +8SO2 ,2SO2+O2催化剂Δ2SO3,SO3 +H2O= H2SO4
C.以石英为原料制取高纯硅:
SiO2+2C Si+2CO↑ Si+2Cl2 SiCl4 SiCl4+2H2Si+4HCl
D.以N2和空气制HNO3:
N2+O22NO,2NO+O2 =2NO2,3NO2+H2O= 2HNO3+NO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com