
题目列表(包括答案和解析)
11.(15分)1998年两位希腊化学家在《科学》杂志上发表论文,称他们在常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,如下图(a)中,氢和氮在电极上合成了氨,且转化率达到了78%。用来合成氨的电解质在电解池里传导H+的作用,它是一种固体复合氧化物(缩写为SCY),具有钙钛矿晶体构型[最小重复单元见图(b)],电解池的两个电极则是吸附在SCY内外表面上的金属钯多晶薄膜。

(1)写出上述电解池阴、阳两极发生的反应和电解池的总反应方程式。
阳极_______________________________________________________________________;
阴极_______________________________________________________________________;
总反应方程式_______________________________________________________________。
(2)钙钛矿晶体中,每个钛原子周围与它最接近且等距离的钛原子共有_____个,氧、钙、钛(Ti)的原子个数比是__________。
10.(15分)X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如下图所示的转化关系。
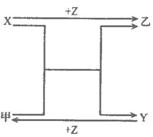
请回答下列问题:
(1)若X为金属单质,Y为固体非金属单质,则甲的电子式为_________,乙的化学式为__________________。
(2)若X、Y均为金属单质,甲为黑色固体,则X与甲反应的化学方程式为_________,其反应类型为_____________________________________________。
(3)若X、Y均为非金属单质,常温下甲为无色液体,写出X与甲反应时的化学方程式___________________________
9.(14分)为测定碳酸钙的纯度(设含杂质SiO2),有学生设计了如下几个实验方案,请回答每个方案中的问题。
方案一:
(1)称取碳酸钙样品Mg;
(2)用cmol·L-1的盐酸VmL(过量)溶解样品;
(3)取溶解后的溶液的十分之一,用c′mol·L-1NaOH溶液滴定,恰好用去V′mL。
问题①:列出本实验中所用到的玻璃仪器名称_____________________________________。
问题②:加盐酸后是否需要滤出SiO2后再用NaOH溶液滴定__________(填选项代号)
A.需要 B.不需要 C.均可
问题③:碳酸钙纯度计算公式___________________________________________。
方案二:
(1)称取碳酸钙样品Mg;
(2)高温烧煅到1 000℃直至质量不再改变,冷却后称量,质量为M′g。
问题①:为什么要煅烧至1 000℃且“直至质量不再改变”?
_____________________________________________________________________________
问题②:本方案中的“冷却”应如何操作?
_____________________________________________________________________________
方案三:
(1)称取碳酸钙样品Mg;
(2)加入足量cmol·L-1盐酸VmL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′mol·L-1Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出洗涤,干燥、称重为M′g。
问题①:此方案中可以不需要的数据是__________(填选项代号)。
A.c、V B.c′、V′ C.M′ D.M
问题②:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定结果:碳酸钙纯度将_________(偏高、偏低、无影响)
综上所述,你认为三个方案中,最好的方案是__________。其他方案的缺点分别是:方案三:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。方案_________,_________。
8.在容积不变的密闭容器中,在一定条件下发生反应:2A B(g)+C(g),且达到平衡。当升高温度时气体的密度增大,则( )
B(g)+C(g),且达到平衡。当升高温度时气体的密度增大,则( )
A.若正反应是吸热反应,则A为非气态 B.若正反应是吸热反应,则A为气态
C.若正反应是放热反应,则A为气态 D.若正反应是放热反应,则A为非气态
7.烯烃复分解反应的研究荣获了2005年诺贝尔化学奖,其反应可形象地描述为“交换舞伴”。催化剂金属卡宾(如CH2=M)与烯烃分子相遇后,“两对舞伴”会暂时组合起来,手拉手跳起“四人舞蹈”。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是新的金属卡宾。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。若把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能生成的是( )
A.C6H5CH2CH=M B.CH2=CH2
C.C6H5CH=CHC6H5 D.C6H5CH2CH=CHCH2C6H5
6.室温下,有下列四种溶液:①0.1 mol·L-1氨水,②0.1mol·L-1 NH4C1溶液,③0.2mol·L-1盐酸与0.2 mol·L-1NH4C1溶液等体积混合,④0.2mol·L-1NaOH溶液与0.2mol·L-1氨水等体积混合,四种溶液中c(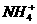 )由大到小排列正确的是( )
)由大到小排列正确的是( )
A.②③④① B.④①②③ C.①④②③ D.③②①④
5.下列离子方程式中错误的是( )
A.稀氨水吸收足量SO2: NH3·H2O
+ SO2====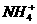 +
+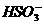
B.向Ca(ClO)2溶液中通入过量二氧化碳ClO-+ H2O + CO2====HClO+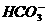
C.稀硝酸中加入铁粉:2Fe+6H+====2 Fe3++3H2↑
D.过氧化钠和冷水反应:2Na2O2+2 H2O ====4 Na++4OH-+O2↑
4.下列有关叙述中正确的是( )
A液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
C.S8和SiO2都是共价化合物,NH4Cl和CaC2都是离子化合物
D.若第ⅡA族某元素的原子序数为m,则同周期第ⅢA族元素的原子序数有可能为m+11
3.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是( )
A.等物质的量的浓度、等体积的(NH4)2SO4与Ba Cl2溶液
B.在NaBr和KI的混合溶液中通入过量Cl2
C.向CuSO4溶液中加入适量NaOH溶液
D.等物质的量的NaHCO3与Na2O2固体
2.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
A.35Cl原子所含质子数为18
B.1/18mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5g的35Cl2气体的体积为1.12L
D.35Cl2气体的摩尔质量为70
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com