
题目列表(包括答案和解析)
19.(6分)如图1,将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g);△H<0。当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
2SO3(g);△H<0。当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
⑴在图2中作出反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线;
⑵当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t3 时间时(t3>t1)重新达到平衡状态,新平衡混合物中气体的总物质的量 ________2.1 mol(填“<”、“>”或“=”)。
⑶若起始时加入0.6 mol SO2、0.3 mol O2和x mol SO3,保持温度不变,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的值为__________。
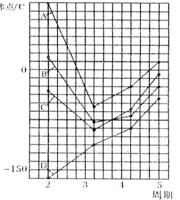
18.(8分)右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D 分别表示____ __ 、__ _____族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是 ;图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是________________ ____ ___。
17.(13分)下图所示装置进行有关实验,将A逐滴加入B中


⑴若A是实验室的一种常用燃料,B是生石灰,实验中观察到C中黑色固体逐渐变红,当C中黑色固体大部分变红时,关闭F,然后往烧杯中加入热水,静止一会,观察到III中试管壁出现了光亮的银镜,则A是 ,C是 ,请写出反应管C中所发生的反应方程式: 。 试管E中所发生反应的离子方程式: 。
⑵若I处酒精灯不加热, B、C仍是实验(1)中原物质,实验中也观察到C中黑色固体逐渐变红,同时可观察到E中溶液先形成沉淀,然后沉淀溶解,并有一种无色无味的气体逸出,当溶液恰好澄清时,关闭F,然后往烧杯中加入热水,静止一会,观察到III中试管壁也出现了光亮的银镜,则A是 ,E中是 与葡萄糖的混合液(写化学式)。请写出反应管C中所发生反应的方程式: 。仪器D在此实验中的作用是 。
⑶若B为浓硫酸,E为苯酚钠溶液,C仍旧不变,A是只含一个碳的一种有机物也能发生银镜反应,实验中同样能观察到C中黑色固体逐渐变红,同时可观察到试管中溶液变浑浊,则A可能是 ,然后往烧杯中加入沸水,可观察到试管中的现象是 ,此实验中浓硫酸的作用是 。写出(1)中A和(3)中A二种物质在浓硫酸存在时所发生的反应方程式:
 ,此反应中浓硫酸的作用是
。
,此反应中浓硫酸的作用是
。
16.(9分)请按要求填空
(1)测定硫酸铜晶体结晶水含量所用到的玻璃仪器有 ;
在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数ω=____________________(写计算式)。
如果实验中加热温度过高,固体颜色变黑,则测定结果会____________(填“不变”、“偏高”、“偏低”)。
(2) 在做银镜反应实验之前试管洗涤步骤依次为:先用 洗、再用自来水洗、最后用蒸馏水洗;
在做过银镜反应实验之后试管洗涤步骤依次为:先用 洗、再用自来水洗、最后用蒸馏水洗;
15.工业生产苯乙烯是利用乙苯的脱氢反应:
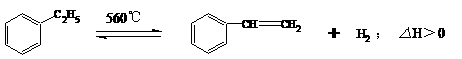
针对上述反应,有人提出如下观点,其中合理的是
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率
C.在加入乙苯至达到平衡的过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
请将选择题答案填入下表:
第Ⅱ卷(非选择题 共90分)
14.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价可看作部分为0价,部分为-2价。下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是

A.晶体中与每个K+距离最近的K+有12个
B.晶体中每个K+ 周围有8个O2-,每个O2-周围有8个K+
C.超氧化钾的化学式为KO2,每个晶胞含有14个K+和13个O2-
D.晶体中,0价氧原子与-2价氧原子的数目比可看作为3∶1
13.下列离子组在pH=0的溶液里能大量共存的是
A.Na+、Fe2+、Cl-、NO3- B.K+、Al3+、HCO3-、SO42-
C.NH4十、Mg2十、Br-、SO42- D.K十、Na+、S2-、SO3 2一
12. MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是
A.MOH是一种强碱
B.在x点,c(M+) = c(R+)
C.在x点,ROH完全电离
D.稀释前,c(ROH) =10 c(MOH)
11.实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于l ,0.1 mol/L某一元碱(BOH)溶液里:C(H+)/C(OH-)=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是
A.C(B+)>C(A-)>C(OH-)>C(H+) B.C(A-)>C(B+)>C(H+)>C(OH-)
C.C(B+)+C (H+)=C(A-)+C(OH-) D.C(B+)>C(A-)>C(H+)>c(OH-)
10.某老师在课堂上做了一个如右图所示的实验,发现烧杯中酸性高锰酸钾溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,最终溶液呈血红色。判断下列说法中正确的是
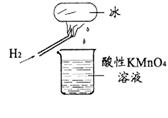
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能还有一定量的H2O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com