
题目列表(包括答案和解析)
2、A、B、C、D、E五种物质有如下转换关系:
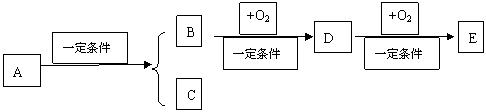

(1)若E是酸酐,且常温下为易挥发的固体,则D的化学式为: ,在一定温度、压强和催化剂作用下提高D转化为E的措施是 ;
(2)若组成A的元素均处在短周期,且B和C均为易溶于水的气体,B能使紫色石蕊试液变蓝,则A的化学式为: ;B转变为D的方程式: ;
(3)若C是可用作自来水消毒的气体,D、E是氧化物,D转变为E时增加氧的质量约为D的总质量的25.8%,则A的化学式为: ,E的电子式: ;
(4)若C是水,B是同系物中相对分子质量最小的物质,B和O2反应生成D是优点显著的D的工业制备方法,E能使紫色石蕊试液变红,则A的结构简式为: ;D转变为E的方程式: 。
1、硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
 (1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下:6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂是
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 溶解、分液 (b) 过滤、洗涤 (c) 蒸发、结晶 (d) 冷却、称量 (e)烘干或灼烧
6、(10分)氯酸钾是一种强氧化剂,多用来制造火柴和烟花等。制取氯酸钾的方法有如下两种。
第一种:无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
(1)电解池中电极反应的方程式是
阴极: ,阳极: 。
(2)写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 。
第二种:无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
(3)第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因 。
(4)已知下列各物质的价格如下表:
|
物质 |
NaCl |
KCl |
NaClO3 |
KClO3 |
KOH |
|
价格(元/50kg) |
500 |
1900 |
4200 |
26000 |
10600 |
从经济效益分析,上述方法中的第 种方法更好,理由是 。
答案(共10分)
① 2H++2e-==H2↑(1分),2Cl--2e-== Cl 2↑(1分)
② (2分)
(2分)
③NaClO3+KCl==KClO3+NaCl(2分);四种物质中氯酸钾的溶解度最小,可以从溶液中析出,使反应向着生成氯酸钾的方向进行。(2分)
④第二种(1分)第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的。(2分)
5、(10分)工业生产中将甲苯在某反应器中被硝酸氧化,放出的氮的氧化物NO和NO2的量分别是3.54 kmol·h-1 和0.26 kmol·h-1。再把所得NO和NO2 与一定量空气混和使之溶于水制成硝酸,假定吸收效率为95%。
(1)写出由氮的氧化物制硝酸的反应方程式。
(2)计算24小时内向环境排放的氮氧化物的物质的量。
(3)假设吸收后的尾气中含5%的O2,试计算出所需空气(O2的体积占20%,N2 的体积占80%)的总体积(单位:m3·h-1 ,即每小时标准状况立方米)。
答案:(10分)(1) 4NO2+O2+2H2O=4HNO3 4NO+3O2+2H2O=4HNO3(2分)(2)24小时内向环境排放的氮的氧化物的量: (3.54kmol·h-1 +0.26kmol·h-1) ×5%×24h=4.56 kmol (2分)
(3)每小时所需空气为x kmol,则尾气中:n(NO2)=(3.54+0.26) ×5%=0.19 kmol(2分)
n(O2)=0.2x -3/4×3.54-1/4×(0.26-0.19)=(0.2x-2.6725) kmol (2分)
因为:n(N2)=0.8x kmol ,由尾气中含5%的O2得到: (0.2x-2.6725):(0.8x+0.19)=5:95
所以:x=17.0 kmol,所需空气的体积=17.0 kmol ×103×22.4L/mol×10-3=380.8 m3.h-1 (2分)
1.⑴C3H7O
⑵判断该核磁共振谱为2-丙醇,因为其分子有三种不同化学环境的氢原子,所以应该有三个氢原子的吸收峰,并且符合1:1:6的峰面积比关系。
4、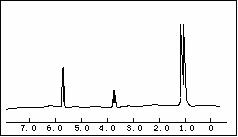 5.8g某含氧衍生物在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重5.4g,氢氧化钠溶液增重13.2g。对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条谱线,下图是该物质的核磁共振氢谱,并且峰面积比分别为1:1:6,
5.8g某含氧衍生物在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重5.4g,氢氧化钠溶液增重13.2g。对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条谱线,下图是该物质的核磁共振氢谱,并且峰面积比分别为1:1:6,
根据上述信息,完成下列问题:
⑴确定该物质的分子式
⑵推测其结构,写出该物质的结构简式
3、(13分)硫代硫酸钠(Na2S2O3 ·5H2O)俗名大苏打、海波,常用于除卤剂和定影剂。Na2S2O3在酸性条件下极不稳定:S2O32-+2H+=H2O+SO2↑+S↓。以Na2S、Na2SO3和浓盐酸为原料。在60℃-80℃用新制的S与Na2SO3反应可制取Na2S2O3;实验装置如下图。(已知H2SO3酸性比H2S强)
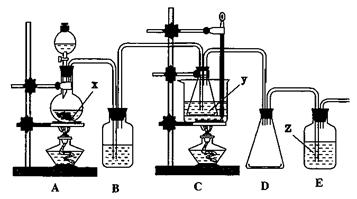 回答下列问题:
回答下列问题:
(1)写出试剂的名称:X ;装置B,D的作用是:B ,D 。
(2)实验开始时,为使反应有效地进行,下列实验操作的顺序是:
①打开A中分液漏斗的活塞,向烧瓶中加入液体;②点燃装置A的酒精灯加热;③点燃装置C的酒精灯加热,。(3)反应开始后,装置C锥形瓶中的溶液先变浑浊,出现浑浊现象的原因是: 、 (用化学方程式表示);当溶液变澄清时,停止反应;然后将所得混合液趁热过滤,经加热蒸发、冷却得到硫代硫酸钠晶体。
(4)实验时,也可先在装置C的锥形瓶中加入一定量的X和Y的混合物,然后按第(2)第(3)步制取Na2S2O3。要使原子利用率达到100%,则X+Y的物质的量之比是: 。
答案(共13分) (1)X:亚硫酸钠 (共2分。写化学式不给分);B:除去SO2气
体中的HCl杂质 ( 2分),D:防止E中液体倒流(或防止倒吸、或安全瓶均可)。(1分)
(2)③①② (2分) (3)Na2S+ SO2+ H2O=Na2SO3+H2S(2分)、
2H2S+SO2=2H2O+3S↓(或2H2S+H2SO3=3H2O+3S↓。2分) (4)1:2(2分)
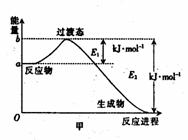
2、(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
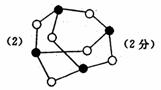
 (2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
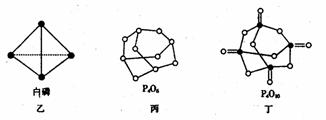
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/kJ·mol-1 |
198 |
360 |
498 |
X |
已知白磷(P4)的燃烧热为2982kJ·mol-1,白磷完全燃烧的产物结构如图丁所示,则上表中x=______
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
(1)P4(s) + 5O2(g) === P4O10(s); △h=-(E2-E1)kJ·mol-1
 (3)585 (4)发638kJ·mol-1
(3)585 (4)发638kJ·mol-1
1、铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,
写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
答案:⑴ 稀盐酸 KSCN溶液 2Fe2++Cl2=2Fe3++2Cl- Fe3++SCN-=[Fe(SCN)]2+
⑵ 少量的Fe2+转化为Fe3+,加入KSCN后显红色 4Fe(OH)2+2H2O+O2=4Fe(OH)3
 ⑶ 不合理 我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
⑶ 不合理 我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
5、氮肥或土壤中的含氮量可以用酸碱滴定法测定。称取氮肥氯化铵0.2000 g于蒸馏瓶中,加蒸馏水溶解后加入过量浓NaOH溶液,加热使产生的氨气导入40.00 mL浓度为0.1004 mol/L的硫酸溶液中被吸收。然后用0.1600 mol/L的NaOH标准溶液滴定余量的硫酸,消耗NaOH标液20.11 mL。
(1)写出滴定反应方程式: 。选用的指示剂是 。
(2)滴定消耗NaOH物质的量为 mmol。
(3)吸收氨消耗的H2SO4物质的量为 mmol。
(4)氮肥试样中氮(相对原子量14)的质量分数为 。
高三化学二卷典型题训练三
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com