
题目列表(包括答案和解析)
1、实验Ⅰ:氢氧化铁胶体(或胶体)(1分);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生(2分);Fe3++3SCN-=Fe(SCN)3(1分);Ba2++SO42-=BaSO4↓(1分)。实验Ⅱ:Fe3+与SO32-同时发生氧化还原反应和双水解反应(2分)2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑(2分)
①SO32-有较强的还原性,CO32-没有还原性(1分);②SO32-水解能力较CO32-小(1分)
1、某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3 SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为 。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅱ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ。实验Ⅰ、Ⅱ产生的现象完全相同。由上述实验得出的结论是 。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:① ;② .
5、(8分)、亚硝酸钠易溶于水,有碱味、氧化性和还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
__NaNO2 + ___KI + __ _____ =___NO +__ I2 +__ K2SO4 + __Na2SO4 +__ _____
(1) 请完成该化学方程式并配平。
(2)在上述反应中,若要生成50.8 g I2,则电子转移数为___________。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是______________________。
(4)现有25.00 mL的KI溶液,用已酸化的10.00 mL 0.0500 mol/L的KIO3溶液处理(5I- + IO3- +6H+ = 3I2 + 3H2O)。将生成的I2全部除去后,再加入过量的KI溶液,使之与剩余的KIO3反应,然后将溶液调节至中性,析出的单质碘用0.1000 mol/L的Na2S2O3溶液滴定(2S2O32- + I2 = S4O62- + 2I-),用去该溶液的体积为21.15 mL,求原KI溶液的物质的量浓度。
答案:(8分)(1)2,2,2,H 2SO4 2,1,1,1,2,H2 O (2分)
(2) 2.408×1023 (或0.4NA) (2分)
(3)反应生成了NO ,该物质会造成大气污染 (2分)
(4)0.0295 mol/L (2分)
4、环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
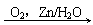 已知:R1-CH=CH-R2
R1-CHO+R2-CHO
已知:R1-CH=CH-R2
R1-CHO+R2-CHO
⑴F的名称是_________,C中含有的官能团的名称是______,H的结构简式为______________。
⑵③的反应条件是____________________。
⑶写出下列有机物的类别:A____________,E___________。
⑷写出下列反应类型:⑥_______________,⑨___________ 。
⑸写出⑩反应的化学方程式: 。
⑹有机物B和I的关系为____________(填序号,多填扣分)
(A)同系物 (B)同分异构体 (C)都属于醇类 (D)都属于烃
 (1)乙二醇;醛基;[ C-C-O-CH2-CH2-O ]n
(1)乙二醇;醛基;[ C-C-O-CH2-CH2-O ]n
(2)NaOH醇溶液、加热 (3)卤代烃;羧酸 (4)氧化;消去



|
(6)C
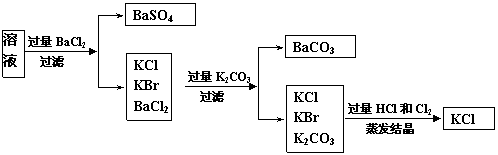
3、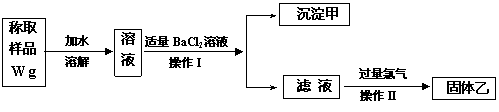 实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
请回答下列问题:
(1)操作I的名称为 ,操作II所需要的玻璃仪器有 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。 。
(3)若实验所得固体甲、乙的质量分别为W 1g和W 2g,则样品中KBr的质量分数计算式为 。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。
(1)过滤,玻璃棒、酒精灯 (2)否,会引入硝酸钾杂质。(3)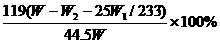 (4)(关键是写出过量K2CO3一步的实验流程,否则不给分)
(4)(关键是写出过量K2CO3一步的实验流程,否则不给分)
2、江苏某某中学的化学兴趣小组为了测定当地某湖泊的水质污染情况,在注入湖泊的四个主要水源的入口处采集水样并检验水样中动植物的种类和数量,结果如下
①号水源的水样中有单一种类的纤毛虫,如草履虫,且数量极多;
②号水源水样中单细胞藻类种类较多,且数量也极多;
③号水样中未发现任何动植物,且发出刺鼻的气味;
④号水源水样中浮游动植物均有发现,但数量不多。根据以上结果回答:
该湖泊的污染源中污染的严重性由重到轻的排列顺序是_________________
(1)①号水源的污染物主要是____;②号水源的污染物主要是_____;③号水源的污染属于_____;
(2)假若①和③号水源的污染属于同一种性质、程度相同,则①号水源排污点离湖泊入水口的距离比③号水源____________.
(3)为了改变湖泊的污染现状,首先必须治理的是__________水源,这一水源一般是由___________排出的废水,治理的方法是_________等几种。
(4)面对湖泊严重污染,有人建议①建立拦污栅,对入湖污水进行预先治理;②将长江水引入冲洗,使死水变活;③利用植物的净水作用,恢复湖中荷藕、菱、水葫芦的种植,并将植物叶茎回收,经沼气池发酵发生沼气。从长远观点看,你同意_________方案(填序号)。不同意有关方案的理由是___________________________________________。
答案(1)③①②④ (2)有机物污染 无机物氮、磷的污染 有毒化学物质的污染
(3)远 (4)③号,化工厂 物理沉降、化学分解、生物净化
(5)①③ 污水冲入长江后会造成二次污染
1、甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH浓硫酸========H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸。
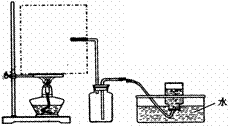 ①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
Ⅰ制备CO Ⅱ Ⅲ收集CO 分液漏斗 长颈漏斗 蒸馏烧瓶 集气瓶 温度计
②装置Ⅱ的作用是 。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3== Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O==2 Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:①碱式碳酸铜的制备:

a、步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是 。
b、步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到 (填写实验现象),说明温度过高。
② 甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
a、 “趁热过滤”中,必须“趁热”的原因是 。
b、用乙醇洗涤晶体的目的是 。
 答案:(10分)(1) ①仪器选择正确并标时液体1分,温度计水银球的位置1分②防止水槽中的水因倒吸流入蒸馏烧瓶中(1分)
答案:(10分)(1) ①仪器选择正确并标时液体1分,温度计水银球的位置1分②防止水槽中的水因倒吸流入蒸馏烧瓶中(1分)
(2)①a、研细并混合均匀(各1分,共2分) b、出现黑色固体(1分)
②a、防止甲酸铜晶体析出b、洗去晶体表面的水和其它杂质(各2分)
5、以天然气、焦炭、水、空气为初始原料,可以制得若干化工产品:
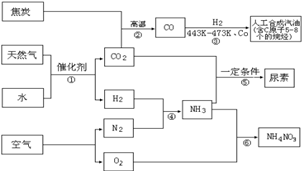 (1)反应③的H2也由反应①得到。若反应①、②、③的转化率均为100%,则将反应①中得到的CO2和H2全部用于合成人工汽油却不能得到理想的产品。
(1)反应③的H2也由反应①得到。若反应①、②、③的转化率均为100%,则将反应①中得到的CO2和H2全部用于合成人工汽油却不能得到理想的产品。
ⅰ)通过计算说明原因。
ⅱ)若要得到理想的产品,则CO2的使用量只要达到反应①中CO2产量的 ;(填数值范围)
(2)通过反应①④⑤合成尿素。若反应④中N2和H2的投料比为V(N2)∶V(H2)=1∶3,
氨合成塔中NH3的体积分数始终保持在25%,要使N2的最终转化率超过95%,则N2和H2至少需要经过 次循环(首次反应不计为1次循环);
(3)通过反应①④⑥合成硝酸铵。若每步反应的转化率均超过95%,则最后得到的产物中N元素质量分数是多少?
高三化学二卷典型题训练一
4、物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
(1)若X为氧化物,X的化学式是___________________________。
(2)若X为单质,X用于焊接钢轨反应的化学方程式是_________________________。
 (3)若X与稀硫酸反应生成无色没有气味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
(3)若X与稀硫酸反应生成无色没有气味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
X与稀硫酸反应的离子方程式是______________;
X与足量稀氢氧化钠溶液反应的离子方程式是_______。
①在宇航器中,可以不断的将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是_________________________。
②科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200℃~250℃时,镍催化剂作用下,生成甲烷和另一种物质。该反应的化学方程式是_____________。
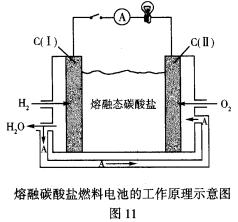
③熔融碳酸盐燃料电池的工作原理如图11所示:
C(Ⅰ)的电极名称是_______(填正极或负极)。该燃料电池的总反应化学方程式是_____________。
3、醛类(R-CHO)分子中碳基上氧原子吸引电子能力强于碳原子,使羰基碳上带有部分正电荷,从而表现出以下两方面的性质:
(1)碳基碳接受带负电荷或带部分负电荷的原子或原子团进攻,而发生加成反应,称为亲核加成反应。
 (2)α一氢(R-CH2-CHO)表现出一定酸性,能与碱作用,产生碳负离子:R-–CH-CHO。
(2)α一氢(R-CH2-CHO)表现出一定酸性,能与碱作用,产生碳负离子:R-–CH-CHO。
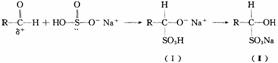
(l)醛与亚硫酸氢钠加成反应的过程如下:
为什么(I)会转化成(Ⅱ)?答:
(2)已知R-CH2-CHO+NH2-NH2→A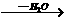 R-CH2-CH=N-NH2,则A的结构简式为
R-CH2-CH=N-NH2,则A的结构简式为
(3)乙醛与乙醇在催化剂作用下,可生成半缩醛(C4H10O2)和缩醛(C6H14O2)。试写出半缩醛的结构简式和缩醛的结构简式:
半缩醛 ;缩醛 。
(4)试写出乙醛与OH-作用产生的碳负离子的电子式 ,
该碳负离子又可进攻另一分子乙醛,而发生加成反应:2CH3CHO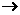 C(分子式:C4H8O2)
C(分子式:C4H8O2)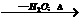 D
D
则C、D的结构简式为:C ,D 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com