
题目列表(包括答案和解析)
2.答案:
⑴②④⑥(3分);⑵①③⑤ (3分) (答对一个给1分,答错1个倒扣1分,本题不得负分。)
2.(6分)⑴下列实验操作中,错误的是
①用10mL量筒量取6.4mL盐酸;
②切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割;
③配制FeSO4溶液,应先将盐溶解在稀硫酸中,再加水稀释到所需浓度,并加入少量铁屑;
④加热烧杯(瓶)时要垫石棉网,所以在加热前,烧杯(瓶)外壁不必擦干;
 ⑤不慎接触过多的氨,应及时吸人新鲜的空气和水蒸气,并用大量水冲洗眼睛;
⑤不慎接触过多的氨,应及时吸人新鲜的空气和水蒸气,并用大量水冲洗眼睛;
⑥用带橡皮塞的棕色试剂瓶存放浓HNO3。
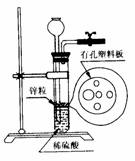
⑵右图为实验室制H2的装置。若液面刚好不与锌粒接触而又无
酸液可加入,则可以从长颈漏斗中加入适量试剂是
①食盐水 ②苯
③四氯化碳 ④Na2CO3溶液
⑤硫酸铜溶液 ⑥KNO3溶液
1.答案(1)4 FeCr2O4+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2,
Al2O3+Na2CO3=2NaAlO2+CO2
(2)产生的二氧化碳从下往上穿过炉料,起到搅拌作用,使炉料疏松,增加与氧气的接触面积,有利于反应的进行。
(3)Al(OH)3、Fe(OH)3
(4)CrO42-+2H+= Cr2O72-+ H2O,不能,Cr2O72-在酸性条件下是强氧化剂,可能被盐酸还原。如酸度太低,CrO42-不能完全转化为Cr2O72-。
1.工业上生产红矾钠(重铬酸钠:Na2Cr2O7)及铬酐(CrO3)的工艺流程如下:
(原料:铬铁矿(主要有FeCr2O4,还含有Al2O3等))

回答下列问题:
(1) 步骤(A)中主反应的化学方程式是
,副反应主要有:Fe2O3+
Na2CO3 2NaFeO2+
CO2↑和
。
2NaFeO2+
CO2↑和
。
(2)在A步中加入石灰石的主要目的不是造渣。但不加石灰石,此反应将很慢,而且反应不完全。加石灰石的作用是 。
(3)在B步中形成废渣的化学式是 ,
(4)C步生成红矾钠的离子方程式是 ;在C步中用硫酸酸化,能否用盐酸酸化: ,理由是 ;在酸化时为什么酸度不能太低 。
1.目前,我国的能源结构主要是煤,还有石油、天然气、核能等,这些能源都是一次不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量。 即:H2(g)十1/2 O2(g)===H2O(l)△H=-285.5kJ/mol
(1)试分析为什么“氢能”将是未来21世纪最理想的新能源?(指出两点优点即可)
,
(2)目前世界上的氢绝大部分是从石油、煤炭和天然气中制取。请写出工业上由天然气制氢气的化学反应方程式。
(3)利用硫-碘热循环法制取氢也是化学家常用的一种方法,总反应方程式为
2H2O 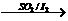 2H2+O2, 其循环过程分三步进行:
2H2+O2, 其循环过程分三步进行:
(a) SO2+I2+H2O→A+B
(b) A→?+?
(c) B→?+?+?
①完成以上三步反应,并确定哪步反应最难进行。
②请对硫-碘热循环法制取氢的优劣和前景作一分析。
(4)目前,氢总量只有4%左右由电解水的方法制取。
 电解水法制氢一方面消耗的电能比氢能释放的能量还要高,另一方面电能本身就是高效、清洁能源,以电能换氢能,成本很高,显然消耗电能来获得氢能的方法是得不偿失。请问用什么方法可以降低电解法制氢的成本。
电解水法制氢一方面消耗的电能比氢能释放的能量还要高,另一方面电能本身就是高效、清洁能源,以电能换氢能,成本很高,显然消耗电能来获得氢能的方法是得不偿失。请问用什么方法可以降低电解法制氢的成本。
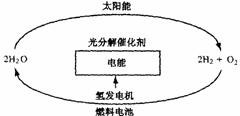
(5)目前,有人提出一种最经济最理想的获得氢能源的循环
体系,如右图所示:
这是一种最理想的氢能源循环体系,类似于生物的光合
作用,太阳能和水是用之不竭,而且价格低廉。急需化
学家研究的是
(6)列举两种方法简单安全地输送氢气。
4. A、B、C、D、E、F、G、H、I、J、K、L、M等为中学化学常见的物质,其中C、D为非金属单质,F、G、H为金属单质,A的稀溶液呈蓝色,常温下B为无色、无味的液体,K是一种污染大气的气体。物质之间的转化关系如下图所示,部分反应物、产物及反应条件未标出。
A、B、C、D、E、F、G、H、I、J、K、L、M等为中学化学常见的物质,其中C、D为非金属单质,F、G、H为金属单质,A的稀溶液呈蓝色,常温下B为无色、无味的液体,K是一种污染大气的气体。物质之间的转化关系如下图所示,部分反应物、产物及反应条件未标出。
⑴I的化学式为 ,通过反应 ②制备1mol G转移的电子的物质的量为 ;
⑵若F和E的稀溶液在加热的条件下也不反应,则下列由F制备A的溶液的方法中,符合绿色化学理念的是 ;
①向E的热稀溶液中加入适量的F和D,至反应完全
②将适量的F和E的浓溶液在加热的条件下反应至完全
③在适量的E的稀溶液中加入适量F和L,或者加入F和M后通入足量空气,反应完全后,调节溶液的pH到3~4,产生沉淀后过滤,滤渣以合理的方式循环使用
④在适量的E的稀溶液中加入适量的F和10%的H2O2溶液后,控制温度在50℃~60℃至反应完全
⑶若F和E的稀溶液在不加热的条件下也能反应,则将F和E的浓溶液在常温下剧烈反应生成的K通入到L的溶液中,发生的反应的离子方程式为 。
3.答案:⑴O3 ⑵Na2S Na2O2


⑶ 2SO2+O2 2SO3 2H2O 2H2↑+O2↑
3.已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见化合物。上述各物质间的相互关系见下图所示(反应条件省略):



 产物之一
产物之一


 甲 丙 B 丙 E 水 丙
甲 丙 B 丙 E 水 丙



|



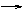
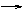
 A
D G
②
A
D G
②






 乙 丙
C 丙 ①
F 水 H溶液
乙 丙
C 丙 ①
F 水 H溶液
试回答:
(1)与丙互为同素异形体的单质是__________________(写化学式)
(2)从A到H八种化合物中摩尔质量相同的是___ _______(写化学式)
(3)写出①②两步的化学方程式:
①________________________________________
②___________________________________ _
2、答案:(1)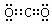 (1分) NA(2分)
(1分) NA(2分)
(2)2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑(2分)
 (3)能,(1分)8NH3+6NO2
(3)能,(1分)8NH3+6NO2 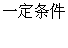 7N2+12H2O(2分)
7N2+12H2O(2分)
(4)Fe3C(2分)
2.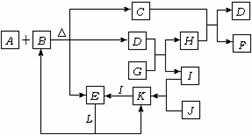 (10分)下图表示各物质之间的转化关系,已知:A是一种由两种元素组成的化合物,它与足量的B的浓溶液反应能生成C、D、E三种物质,F是一种红褐色沉淀,常温下,L为无色液体,D、J为无色气体,I为气体单质,且J能使湿润的红色石蕊试纸变蓝。(部分反应物、生成物已略去)
(10分)下图表示各物质之间的转化关系,已知:A是一种由两种元素组成的化合物,它与足量的B的浓溶液反应能生成C、D、E三种物质,F是一种红褐色沉淀,常温下,L为无色液体,D、J为无色气体,I为气体单质,且J能使湿润的红色石蕊试纸变蓝。(部分反应物、生成物已略去)
D的电子式是 ,1mol D与足量G反应时转移电子的数目为 。
写出C与H的水溶液反应的离子方程式: 。
在一定条件下,E和J能否发生反应 (填“能”或“否”)若能发生反应,写出反应的化学方程式,若不能,说明理由 。
(4)若化合物A中某元素的质量分数为 ,则A的化学式为
。
,则A的化学式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com