
题目列表(包括答案和解析)
1、方法与技巧
①等价转化思想:等价转化思想是一种数学思想,借助到化学平衡中,可以简化分析过程。化学平衡状态的建立与反应途径无关,无论可逆反应是从正反应方向开始,还是从逆反应方向开始,或从中间状态开始,只要起始投入的物质的量相当,则均可达到等效平衡状态。这里所说的“相当”即“等价转化”的意思。
②放大缩小思想:该方法适用于起始投入的物质的量存在于一定倍数关系的反应。它指的是将反应容积的梯级扩大一定的倍数,让起始反应物的浓度相同,则在一定的条件下,可建立相同的平衡状态。然后,在此基础上,进行压缩,使其还原为原来的浓度。分析在压缩过程中,平衡如何移动,再根据勒夏特列原理,分析相关量的变化情况。
③大于零思想:对于可逆反应,不论什么情况下,一定是反应物与生成物共存的状态,即任何物质的物质的量均大于零。
4.理解水的电离及电解质的电离平衡概念。
[典型例析]
[例1]在化学中存在着各类平衡,请同学们列举我们所接触到的各类平衡?
|
平衡类型 |
举例 |
平衡特征 |
遵循原理 |
|
化学平衡 |
N2 + 3H2
D 2NH3 |
动 等 定 变 |
勒夏特列原理 |
|
电离平衡 |
HAc DH++ Ac-
|
||
|
水解平衡 |
Ac-+H2O D HAc + OH- |
||
|
溶解平衡 |
Mg(OH)2(s) DMg2+(aq) + 2OH-(aq) |
[点评]通过举例使学生了解化学中的各种平衡。
[例2] 在日常生产、生活中,我们在哪些方面应用了勒夏特列原理?
|
生产生活实例 |
涉及的平衡 |
根据勒原理所采取的措施或原因解释 |
|
1.接触法制硫酸 |
2SO2+O2 D 2SO3 |
通入过量的空气 |
|
2.合成氨工业 |
N2+3H2 D 2NH3 |
高压(20MPa-50MPa),及时分离液化氨气 |
|
3.金属钠从熔化的氯化钾中置换金属钾 |
Na + KCl D
NaCl + K |
控制好温度使得钾以气态形式逸出。 |
|
4.候氏制碱法 |
NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaClD NaHCO3+NH4Cl |
先向饱和食盐水中通入足量氨气 |
|
5.草木灰和铵态氮肥不能混合使用 |
CO32-+H2OD HCO3-+OH- NH4++H20D NH3·H2O + H+ |
两水解相互促进,形成更多的NH3·H2O,损失肥效 |
|
6.配置三氯化铁溶液应在浓盐酸中进行 |
Fe3++3H2OD Fe3++3H+ |
在强酸性环境下,Fe3+的水解受到抑制 |
|
7.用热的石碱水洗油腻 |
CO32-+H2OD HCO3-+OH- |
加热促进水解,OH-离子浓度增大 |
[点评]通过举例使学生了解日常生活、生产中所涉及到的各种平衡,及各种平衡的具体应用。
[例3](04江苏18题)在容积固定的密闭容器中存在如下反应: A(g)+3B(g)  2C(g);△H<0
2C(g);△H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
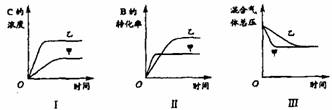
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
[解析]催化剂只能改变化学反应速率,不能使化学平衡发生移动,若研究催化剂对反应的影响,则图Ⅰ中甲、乙两种情况下C的浓度应该相等;图Ⅱ若是研究压强对反应的影响,由于甲先达平衡,则甲的压强比乙大,而压强越大B的转化率越高,与图Ⅱ矛盾;图Ⅱ若是研究温度对反应的影响,由于甲先达平衡,则甲的温度比乙高,而正反应方向放热,所以从乙→甲平衡向逆反应方向移动,B的转化率减小与图Ⅱ相符;图Ⅲ中甲、乙达到相同的平衡状态且甲先达平衡,与D项所述情况相符。
[答案]A B
[点评]本题主要考查外界条件(温度、压强、催化剂)对化学平衡的影响及学生对图象的分析能力。
[例4](03江苏第18题)将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A c(HCN)<c(CN-) B c(Na+)>c(CN-)
C c(HCN)-c(CN-)=c(OH-) D c(HCN)+c(CN-)=0.1mol·L-1
[解析]0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,得到0.05mol·L-1HCN和0.05mol·L-1 NaCN的混合溶液,由于混合以后溶液显碱性。即CN-水解程度大于HCN电离程度,所以c(HCN) >c(CN-) 。所以A错误。根据电荷守恒c(Na+)+C(H+)=C(OH-)+ c(CN-),因为C(OH-)>C(H+),所以c(Na+)>c(CN-),所以B正确。根据物料平衡c(HCN) +c(CN-)=0.05mol·L-1+0.05mol·L-1=0.1mol·L-1 所以D正确。假如HCN不电离,则水解了的CN- 应等于OH-,即c(CN-) + C(OH-)= c(HCN),而实际上HCN 存在电离平衡,所以C 错误。
[答案]BD
[点评]本题涉及酸碱中和反应以及电解质的电离和盐类的水解两种平衡,是一道考查思维灵敏和严密性的综合题。
[例5](江苏26、03年第26题)(12分)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)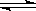 C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是
。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
[解析]
(1)由于平衡时生成a molC,则同时反应了A 、B各a mol,所以平衡时A的物质的量为(1-a)mol 。
(2)由于在恒温、恒压下,开始时加入3molA和3molB,达平衡后,生成C的物质量也是开始时的3倍,即C 的物质量为3(1-a)mol 。
(3)达平衡后,C 的物质的量是3a mol ,与(2)等效,则开始时放入的各物质也与(2)等效。所以X+1=3,即X =2。Y=3(1-a)mol。平衡时B的物质量也为(3-3a )mol。当a=1/3时,(3-3a )等于2,当a <1/3时,(3-3a )>2,当a >1/3时,(3-3a )<2。选丁。
(4)若在(3)的平衡混合物中再加入3molC,由于是恒温、恒压,所以平衡时与(1)等效,所以达平衡时,C 的物质的量分数与(1)相同,即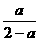 。
。
(5)由于温度和体积不变,随着反应的进行,压强变小,平衡向逆方向移动,所以平衡时C 的物质的量b <a,选乙。
[答案](1)(1-a) (2)3a (3)2 3-3 a 丁
若3a>1,B的物质的量小于2mol;若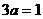 ,B的物质的量等于2mol;
,B的物质的量等于2mol;
若3a<1,B的物质的量大于2mol
(4)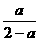
(5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
[点评]本题考查的知识点是化学平衡及平衡移动等基本概念;考查学生分析问题、开发信息、发现规律和运用规律,从而解决问题的能力,是属于探究性层次的试题。
本题分两部分:Ⅰ.是在恒温恒压下的气体反应:A(g)+B(g)===C(g)是气体物质的量减少的原因,因此也是恒压时体积缩小的反应。题目设置了三种情况,有层次地向考生提出问题,解决了前一问题,就为解决后一问题提供了台阶。
Ⅱ.设置的情景是起始条件相同、恒容时建立平衡和恒压时建立平衡两种情况下,比较C 的物质的量的大小。
[方法归纳]
3.理解勒沙特列原理的含义。掌握浓度、温度、压强等条件对化学平衡移动的影响。
2.了解化学反应的可逆性。理解化学平衡的含义及其与反应速率的内在联系。
1.了解化学中的各种平衡。
12、(20分)
(Ⅰ)K2Cr2O7和H2O2在H2SO4溶液中混合时,可以看到下面两个现象:
①混合后5s-10s内,溶液由橙色变暗蓝色;
②在80s -160s内由暗蓝色变为绿色,与此同时,放出气泡。
与之相对应的两个方程式为:
A:Cr2O72‑+H2O2→CrO5+H2O
 B:CrO5+H+→Cr3++O2↑
B:CrO5+H+→Cr3++O2↑
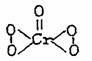
CrO5的结构式为:
(1)指出A、B是否属于氧化原还反应。
(2)配平A、B反应组成的总反应方程式,并标出反应的电子转移方向和数目。
(3)若反应中生成O2 11.2L(标准状况),H2O2 (填:得到或失去)电子的数目为 个。
(Ⅱ)将KOH和Ca(OH)2混合物1.86 g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况。以下情况相同。)
(1)生成沉淀的质量刚好最大时,反应的方程式为:
。
(2)原混合物中Ca(OH)2的质量为 g。
(3)沉淀恰好溶解时,消耗CO2的体积为 mL
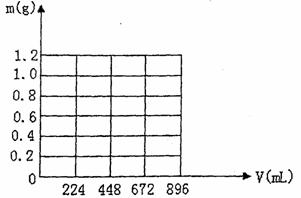 (4)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线。
(4)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线。
11、(10分)有一种复盐X,其水溶液呈现浅绿色,在一定条件下,X可发生如下的转化关系,其中B、D、E、I为无色气体,M、K为常见的金属,H为红棕色的粉末,在溶液A中加入盐酸酸化,再加BaCl2溶液,生成白色沉淀。
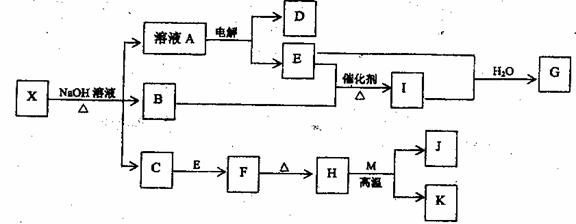
回答下列问题:
(1)B气体的检验方法是 。
(2)写出下列有关的化学方程式:
①电解溶液A:
②X与NaOH溶液共热
(3)写出K与过量G稀溶液反应的离子方程式:
10.(15分)现有A-F六种化合物,有关它们的信息如下。①、②中有一反应是与Br2的CCl4溶液的加成反应。1molF在碱性条件下水解生成1molG和1molH。G为油脂的水解产物。
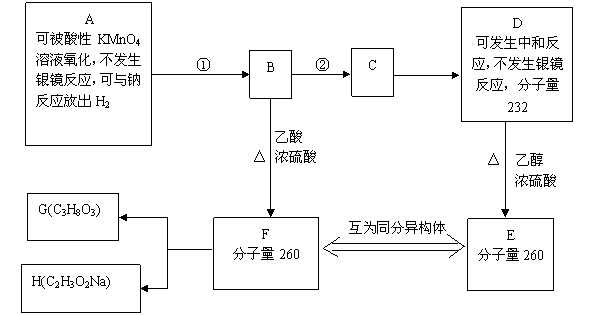
 请回答下列问题
请回答下列问题
(1)与Br2的CCl4溶液发生加成反应的是 (填反应编号①或②)
(2)D中含有的官能团有
(3)A的结构简式为 ;E的结构简式为
(4)写出F在碱性条件下水解的化学方程式
_______________________________________________________________________________
9、(15分)二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解。以下是氯气与硫合成二氯化硫的实验装置。
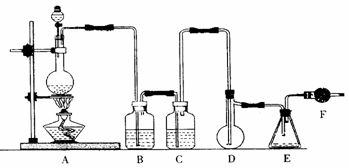
试回答下列问题
(1)装置A中发生反应的化学方程式为 。
(2)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是
。
(3)实验时,D装置需加热至50-59℃.最好采用 方式加热。如何防止E中液体挥发 。
(4)F装置中干燥管内所盛物质的作用是 。
(5)二氯化硫电子式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com