
题目列表(包括答案和解析)
22.一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是___________________,
②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是___________________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为_____________________,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的
顺序为______________________。
⑤当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则开
始时反应速率__________________,反应所需的时间___________________。
⑥将c(H+)相同的三种酸均稀释10倍,c(H+)由大到小的顺序为__________________。
21.常温下将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液。
⑴用化学用语表示该溶液中的三个平衡关系是:①________________________;
②___________________;③______________________________________。
⑵这些微粒中浓度为0.01mol/L的是________浓度为0.002mol/L的是_________。
⑶物质的量之和为0.01mol的两种微粒是_________________。
⑷ _________和________两种微粒数量之和比OH-多0.008mol。
20、(10分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3molC和2molD,将两容器的温度恒定在770K,使反应3A(g)+B(g) xC(g) +D(s)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g) +D(s)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________。
(2)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),平衡时甲中A的体积分数为____________。
(3) 若平衡时,甲、乙两容器中A的物质的量相等,改为按不同配比作为乙的起始物质,达到平衡后,C的体积分数都仍为0.2。
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是________
②若加入0.6molA和0.2molB,则C和D起始物质的量分别应满足______,______
(4)若平衡时两容器中的压强不相等,则两容器中压强之比为_____________。
19.⑴反应mA+nB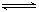 pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是______。
②若C为气体,且m+ n =p,在加压时化学平衡发生移动,则平衡必定向____方向移动。
③如果在体系中增加或减少B的量,平衡不发生移动,则B肯定不能为_____态。
④若升高温度,A的转化率降低,则此反应的逆反应是_______热反应。
⑵有可逆反应:A(g)+B(g)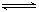 3C(g),下图分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间表(t)的关系图。
3C(g),下图分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间表(t)的关系图。
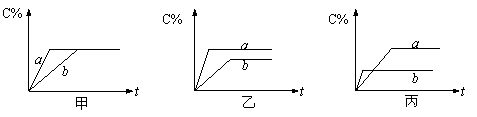
按下述要求填空:
①若甲图中两条曲线分别表示有无催化剂时的情况,则______曲线表示无催化剂。
②若乙图中两条曲线分别表示200℃和100℃的情况,则该可逆反应的正反应是_____热反应。
③若丙图中的两条曲线分别表示不同压强下的情况,则____曲线表示压强较大时的情况。
18、已知,(1)Cu2+、Fe2+在pH=4-5的条件下不水解,而Fe3+几乎全部水解。(2)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。现用粗氧化铜(含少量铁)制取氯化铜溶液的过程如下:
①取50mL纯净盐酸,加入一定量粗氧化铜,加热搅拌,充分反应后过滤,测得滤液pH为3。
②向滤液中加入双氧水、搅拌。
③调节②中的溶液的为4,过滤。
④把③所得滤液浓缩。
回答以下问题:
(1)②中所发生反应的离子方程式是 。
(2)③中使pH升到4采取的措施是,加入过量的( ),并微热、搅拌。
A.氢氧化钠 B.氨水 C.氯化铜 D.氧化铜
(3)③中过滤后的滤渣的成分是 。
17、(01上海26)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现 象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
(1)100mL容量瓶(注:未标明规格的扣 分) (2)>b(多选扣分) (3)配制pH=l的HA溶液难以实现 不妥之处在于加入的锌粒难以做到表面积相同
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质
16.(04全国Ⅰ29)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
 N2
(g) + 3 H2(g)
2NH3(g)
N2
(g) + 3 H2(g)
2NH3(g)
⑴若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值 ⑵反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。计算平移时NH3的物质的量。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
⑷原混合气体中,a∶b = 。
⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。 ⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
18.答案: AB
15、(05江苏18)一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 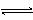 3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A.2mol C B.2molA、1molB和1molHe(不参加反应)
C.1molB和1molC D.2molA、3molB和3molC
14、(01上海19)将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A.c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C.c (Ac-)=c (Cl+)>c (H+)>c (HAc)
D.c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com