
题目列表(包括答案和解析)
26.(7分)过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化物样品的组成,进行了如下实验。
① 称取0.270克样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为33.6毫升。
② 另取0.120克样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200摩/升KMnO4溶液滴定,共用去31.0毫升KMnO4溶液。化学方程式如下: 5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2+8H2O
(1)计算样品中的CaO2的质量分数。
(2)计算样品中的CaO2·xH2O的x值。
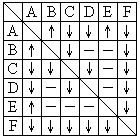 24.(本小题10分)有A、B、C、D、E、F六瓶未知溶液.它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH.为了鉴别,各取少许溶液进行两两混和试验,结果如右表.表中"↓"表示有沉淀或生成微溶化合物,"↑"表示有气体生成,"-"表示观察不到明显的现象变化。
24.(本小题10分)有A、B、C、D、E、F六瓶未知溶液.它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH.为了鉴别,各取少许溶液进行两两混和试验,结果如右表.表中"↓"表示有沉淀或生成微溶化合物,"↑"表示有气体生成,"-"表示观察不到明显的现象变化。
(1)请写出下列物质的化学式:
C 、D 、E 、F .
(2)写出A、B反应的离子方程式: _____________________________________________。
25.(10分)甲状腺激素对于人和高等动物具有极其重要的生理作用,下图是关于碘及其化合物与甲状腺素的转化网络图示。
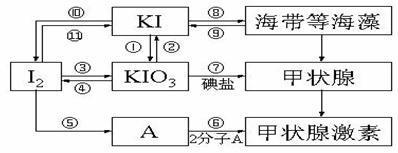
(1)请写出在强酸性条件下,由KI和KIO3反应制得I2的离子反应方程式:_____________________________________________________________________。
(2)上述各反应中,碘元素发生氧化反应的过程有_________________ (填序号)。
(3)制备KIO3的方法较多:
③的原理是I2在一定条件下还原KClO3,写出该反应的化学方程式:________
_____________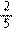
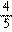
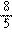 ___________________________________________。
___________________________________________。
① 的原理是以石墨为阳极,不锈钢为阴极,KI溶液为电解质溶液(混有K2Cr2O7)电解,总反应方程式为KI+3H2O KIO3+3H2↑。①试写出阴极反应方程式:________
______________________________________________________________。
KIO3+3H2↑。①试写出阴极反应方程式:________
______________________________________________________________。
(4)甲状腺激素的结构简式为:
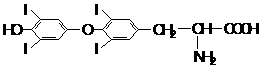
由2分子A通过取代反应可以生成甲状腺激素和丙氨酸(α-氨基丙酸),请写出该反应的化学方程式(不必注明条件):_____________ ___ __。
23.(17分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
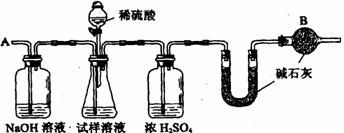
主要实验步骤如下:
① 按图组装仪器,并检查装置的气密性
② 用托盘天平称取6.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量得到32.6 g
④ 从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到34.8 g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变。
请填空和回答问题:
(1)简述用托盘天平称取6.0g样品的操作步骤(天平已调平)_________________________________________________________________________________。
(2)在③步骤中称量质量时涉及到多步添加,撤去法码的操作,请用“↓”表示在托盘上加上砝码,“↑”表示从托盘上取下砝码的称量过程。(法码有50g、20g、10g、5g、2g、1g等多种规格,1g以下移动游码)注:表格可不填满
|
砝码质量/g |
50 |
20 |
|
|
|
|
|
|
|
|
称量过程 |
↓↑ |
|
|
|
|
|
|
|
|
(3)装置中干燥管B的作用是
(4)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)
(5)步骤⑤的目的是_____________________________、A中NaOH溶液的作用是________________________________________________________________。
(6)步骤⑦的目的是
(7)该试样中纯碱的质量分数为(精确到0.1) .
22.(6分)1840年前后,俄国科学家盖斯(Hess)指出,一个化学反应的热效应仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”。现已知在101KPa下CH4、H2、C(固)的燃烧热分别为890.83KJ/mol、285.83 KJ/mol和393.51 KJ/mol,则反应C(s)+2H2(g)=CH4(g)的反应热△H=___________,根据以上信息,你认为“盖斯定理”在我们确定一些化学反应的反应热时有何重要意义_________________________。
21.
 (19分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
(19分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
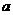
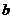
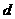
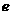
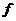
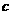
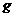
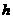
(1)上述元素的单质中熔点最高的可能是 _____(填字母)。
(2) 比
比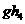 稳定,其原因是______________________________________________的缘故。
稳定,其原因是______________________________________________的缘故。
(3)在一定条件下,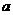 与
与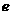 可形成一种极易溶于水的气态化合物,其电子式为
;该物质溶于水后的溶液呈 性(填“酸”、“碱”或“中”),这是由于___________________________________________________(结合该物质分子结构的特点解释)
可形成一种极易溶于水的气态化合物,其电子式为
;该物质溶于水后的溶液呈 性(填“酸”、“碱”或“中”),这是由于___________________________________________________(结合该物质分子结构的特点解释)
(4)现有另一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,则X是周期表中_________族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的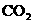 ,你认为该物质应该是由上表中的_______(填字母)元素组成的,用电子式表示该物质的形成_____________________________________________。飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体分子式为________。另在运送飞船的火箭推进器中盛有分别由ae和af元素组成的两种液态化合物,它们的分子皆为18电子微粒,当它们混合反应时即产生e的单质和a2f。请写出该反应的化学方程式为____________________________。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是______________________________________________。
,你认为该物质应该是由上表中的_______(填字母)元素组成的,用电子式表示该物质的形成_____________________________________________。飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体分子式为________。另在运送飞船的火箭推进器中盛有分别由ae和af元素组成的两种液态化合物,它们的分子皆为18电子微粒,当它们混合反应时即产生e的单质和a2f。请写出该反应的化学方程式为____________________________。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是______________________________________________。
20.(6分)以下各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有( )
19.在一定量饱和的澄清石灰水中,加入5.60克CaO后充分搅拌,静置恢复到原来的温度,发现石灰水下部有白色不溶物形成,则下列叙述正确的是( A )
A.白色不溶物为CaO,其质量为5.60克
B.白色不溶物为Ca(OH)2,其质量为7.40克
C.石灰水的浓度和质量均不会变化
D.石灰水的质量将会减少,石灰水的pH不会发生变化
18.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已知:FeSO4+ KMnO4+ H2SO4= Fe2(SO4)3+ K2SO4+ MnSO4+ H2O(未配平),则在上述反应中,羟胺的氧化产物是( B )
A.N2 B.N2O C.NO D.NO2
17.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( A )
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I- = 2Fe2+ + I2
16.已知热化学方程式2SO2(g)+
O2(g)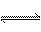 2
SO3(g) △H= -Q kJ/mol(Q>0),则下列说法正确的是( D )
2
SO3(g) △H= -Q kJ/mol(Q>0),则下列说法正确的是( D )
A.2molSO2(g)和1mol O2(g)所具有的内能小于2 molSO3(g)所具有的内能
B.将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QKJ的热量
C.升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小
D.如将一定量SO2(g)和 O2(g)置于某密闭容器中充分反应后放热QKJ,则此过程中有2molSO2(g)被氧化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com