
题目列表(包括答案和解析)
1、下列说法中,正确的是
A.非极性共价键只存在于单质中
B.离子键只能存在于化合物中
C.分子晶体里只存在分子间作用力,不存在化学键
D.具有正四面体结构的分子,如CH4、CCl4、P4等,其中键角都是109°28’
25.(10分)Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂。工业上制得的Na2S2O3·5H2O晶体中可能含有少量的Na2SO3和Na2SO4杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30.00mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出。(Na2S2O3+H2SO4 = Na2SO4+SO2↑+S↓+H2O)测得有关实验数据如下(标准状况):
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
7.540 |
15.08 |
35.00 |
|
二氧化硫的体积/L |
0.672 |
1.344 |
2.688 |
|
硫的质量/g |
0.8000 |
1.600 |
3.200 |
(摩尔质量:Na2S2O3·5H2O 248g/mol;Na2SO3 126g/mol;Na2SO4 142g/mol)
(1)计算所用硫酸溶液的物质的量浓度。
(2)分析以上实验数据,该样品中 (填写选项字母)
 A.仅含有Na2S2O3·5H2O
A.仅含有Na2S2O3·5H2O
B.含有Na2S2O3·5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3·5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热。试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的SO2体积(bL)的值(可用含a的关系式表示)。
24.(8分)有Ba(OH)2、NaHSO4、NaHCO3三种溶液。已知其中两种溶液的物质的量浓度相等且为另一种的2倍。若先将NaHSO4和NaHCO3溶液各100mL混合反应后,再向所得溶液中加入100mLBa(OH)2溶液,将生成的白色沉淀滤出,所剩滤液中只有NaOH一种溶质,且c(NaOH)=0.9mol·L-1(溶液混合时引起的体积变化忽略)。
(1)试分析推断下列结论中,正确的是____________(选填序号)。
A、c[Ba(OH)2]≠c(NaHSO4)4 B、c[Ba(OH)2]≠c(NaHCO3)
C、c(NaHSO4)≠c(NaHCO3)
(2)请计算三种溶液的可能的物质的量浓度。
23. (10分)已知:①卤代烃在一定条件下可以和金属反应,生成烃基金属有机化合物,后者又能与含羰基(
)的化合物反应生成醇,其过程可表示如下:
(10分)已知:①卤代烃在一定条件下可以和金属反应,生成烃基金属有机化合物,后者又能与含羰基(
)的化合物反应生成醇,其过程可表示如下:


② 有机酸和PCl3反应可以得到羧酸的衍生物酰卤:
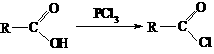
③苯在AlCl3催化下能与酰卤作用生成含羰基的化合物:
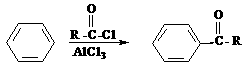
科学研究发现,有机物X、Y在医学、化工等方面具有重要的作用,其分子式均为C10H14O,都能与钠反应放出氢气,并均可经上述反应合成,但X、Y又不能从羰基化合物直接加氢还原得到。X与浓硫酸加热可得到M和M',而Y与浓硫酸加热得到N和N'。M、N分子中含有两个甲基,而M'和N'分子中含有一个甲基。下列是以最基础的石油产品(乙烯、丙烯、丙烷、苯等)及无机试剂为原料合成X的路线:
其中C溶液能发生银镜发应。请回答下列问题:
(1)上述反应中属于加成反应的是____________________ (填写序号)
(2)写出C、Y的结构简式:C___________________ Y _________________
(3)写出X与浓硫酸加热得到M的化学反应方程式____________________
过程⑤中物质E+F→G的化学反应方程式____________________
22. (8分)2006年8月3日,国家食品药品监督管理局紧急向全国通报,某厂生产的“欣弗”克林霉素磷酸酯葡萄糖(以下简称“欣弗”)注射液,在多个省出现严重不良反应病例。国家药监局要求各地停用该厂产品,回收其药品。
(8分)2006年8月3日,国家食品药品监督管理局紧急向全国通报,某厂生产的“欣弗”克林霉素磷酸酯葡萄糖(以下简称“欣弗”)注射液,在多个省出现严重不良反应病例。国家药监局要求各地停用该厂产品,回收其药品。
已知:(1)“欣弗”在酸性条件下可水解生成A:
、B(C9H18SNCl)、C(H3PO4)
(2)新型农药甲与A互为同分异构体,甲物质满足以下关系:

请回答下列问题:
(1)A的分子式为 ;
(2)甲的结构简式为 ;
(3)写出下列各步的反应类型① 、④ ;
(4)写出丙生成丁的化学反应方程式 。
21.(14分) 往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:

(1) 精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx•mH2O],反应的化学方程式为 。
.... (2) 合成反应后,继续在393K-523K下水热处理8h,发生反应:
[Mg(OH)2-xClx•mH2O]== (1-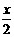 ) Mg(OH)2 +
) Mg(OH)2 +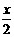 MgCl2 + mH2O
MgCl2 + mH2O
水热处理后,过滤、水洗。水洗的目的是 。
(3) 阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是 。
(4) 已知热化学方程式:Mg(OH)2(s) == MgO(s) + H2O(g);△H1 = +81.5 kJ·mol-1
Al(OH)3(s)
== 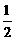 Al2O3(s) +
Al2O3(s) +  H2O(g);△H 2 = +87.7 kJ·mol-1
H2O(g);△H 2 = +87.7 kJ·mol-1
等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,原因是 。
(5) 常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是
(填代号),理由是 。
20.(10分)2004年美国火星探测车在火星大气层中检测到了A气体。资料显示,A气体分子是一种三原子分子,其相对分子质量为60.0,在地球环境下A不太稳定,易分解得到一种单质和一种化合物。粉末状的KSCN与浓硫酸在一定条件下可得到气体A和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1
(1)试推测火星大气层的温度,简述你的理由。
(2)试确定A的化学式 。
(3)写出KSCN与浓硫酸反应的化学反应方程式 。
(4)A分解得到一种单质和一种氧化物,写出A分解的化学反应方程式 。
(5)B与SO3反应得到A与一种淡黄色的固体单质。已知B由两种元素组成,A和B分子中原子的最外层电子总数相等,B中两元素的质量比为3∶16。试写出B与SO3反应制备A的化学反应方程式: 。
19.(8分)现有A、B、C、D、E、F、G、H、I九种常见的物质,其中常温下A、B、F、H、I为气体,E、I为单质,G溶液呈蓝色,现代医学研究表明F分子在人体内有独特功能,它与血红蛋白结合的能力比CO更强。H分子中含有10个电子,A、B最简式相同,A的相对分子质量大于B的相对分子质量。A-I九种物质间的相互转化关系如下:
 试回答以下问题:
试回答以下问题:
(1)写出H分子的电子式
(2)写出反应①的化学方程式:
反应②的离子方程式:
(3)实验室若要测定B分子的分子量,适宜的条件是 。
18.(14分)学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、______ __、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:
(1) 在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、_________、________
(2)实验编号3的实验中KClO3的分解率为___________________%(保留一位小数)
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用___________________试纸检验。上述异常现象产生的原因是_________________________________________________________。
VI 实验结论:_____________________________________________________________
17.某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发同耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1 535 |
|
沸点(℃) |
2 467 |
2 750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?
(填“合理”或“不合理”)。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:
。
(3)设计一个简单的实验方案,证明上述所得的熔融物中含物中含有金属铝。请填写下列表格:
|
所用试剂 |
|
|
实验操作及现象 |
|
|
有关反应的化学方程式 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com