
题目列表(包括答案和解析)
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ/mol)
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。 。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
答案:(1)①④
(2)①Li原子失去1个电子后形成稳定结构,再失去1个电子很困难
②a Na2O或Na2O2
③ⅢA族或第三主
④m
解析:(1)从所给元素在周期表中的位置不难知道a、c、d、f分别为Na、Mg、Sr和Al,e处于过渡元素区也一定为金属,它们都是电的良导体;h为碳元素,其单质中的一种石墨也是电的良导体,故应选①、④两组。
(2)①锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子处于稳定结构,根据题给信息2可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量。
②由表中数据可知:X失去第2个电子所需能量远大于失去第一个电子所需的能量(9倍多),而失去第三个、第四个电子所需能量皆不足前者的2倍,故第一个电子为最外层的1个电子,而其他几个电子应处于内层。结合所给的周期表知,X应为a即钠元素和j即氧元素所形成的化合物化学式分别为Na2O和Na2O2。
③由表中所给Y的数据可知,Y失去第1、2、3个电子所需能量差别不大,而失去第4个电子所需能量远大于失去第3个电子所需的能量,因此Y元素的最外层有3个电子即为第ⅢA族的元素Al。
④从题目所给信息知道,原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关。结构越稳定失电子所需能量越高,在所给13种元素中,处于零族的m元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多。
[方法归纳]
3.以上知识是高考必考内容,常以选择题、简答题和推断填空题的形式出现。
[典型例题]
[例1]例1(2003上海理综)在人体所需的16种微量元素中有一种被称为生命元素的R 元素,对延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称
A. 硫 B. 砷 C. 硒 D. 硅
[备选1]:周期表前20号元素中,某两种元素的原子序数相差1,它们形成化合物时,原子数之比为1﹕2,写出这些化合物的化学式______________
[备选2]:X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化学式不可能是
A. XYZ B.X2YZ C.X2YZ2 D.X3YZ3
[例2]下列有关物质的性质比较正确的是
(1) 同主族元素的单质从上到下,非金属性减弱,熔点增高
(2) 元素的最高正化合价在数值上等于它所在的族序数
(3) 同周期主族元素的原子半径越小,越难失去电子
(4) 元素的非金属性越强,它的气态氢化物水溶液的酸性越强
(5) 还原性:S2->Se2->Br->Cl-
(6) 酸性:HClO4>H2SO4>H3PO4>H2SiO3
A.(1)(3) B.(2)(4) C.(3)(6) D.(5)(6)
[备选1]下表是X、Y、Z三种元素的氢化物的某些性质:
|
元素 |
熔点/℃ |
沸点/℃ |
与水的反应 |
导电性(纯液体) |
|
X |
-283 |
-162 |
不反应 |
不导电 |
|
Y |
-102 |
19 |
放热反应,形成酸性溶液 |
不导电 |
|
Z |
680 |
/ |
剧烈反应,生成H2,并形成碱性溶液 |
导电 |
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是
A. X、Y、Z B. Z、X、Y C. Y、X、Z D. Z、Y、X
[例3] (2003上海)下表是元素周期表的一部分,表中所列的字母分别表示一种化学元素。
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
j |
|
|
|
a |
c |
|
|
|
|
|
|
|
|
|
|
f |
|
i |
|
l |
m |
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)下列 (填写编号)组元素可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
2.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
1.掌握元素周期率的实质,了解元素周期表(长式)的结构(周期、族)。
25.
 (10分)24.(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:N2(g)+3 H2 (g) 2NH3
(g); △H=-92.4 kJ/mol 。
(10分)24.(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:N2(g)+3 H2 (g) 2NH3
(g); △H=-92.4 kJ/mol 。
保持温度不变,A、B容器中的反应均达到平衡状态。平衡时,A容器中气体体积为起始时的4/5,平衡状态记为P。 试回答下列问题:
(1) 平衡时A容器中NH3 的体积分数是 。若要使B容器中NH3 的体积分数与 A容器中相同,可采取的措施是 。
(2) 若保持温度不变,向B容器中补加c mol NH3 ,再次达到平衡时,A、B两容器中压强恰好相等,则c= 。
(3)若保持温度不变,开始时向容器A中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原A平衡状态P相同,则起始时,c的取值范围是 。
(4)若保持温度不变,开始时向容器B中加入a mol N2 、b mol H2 和 1 mol NH3 ,平衡时,测得放出的热量为23.1 kJ,NH3 的体积分数与A容器平衡状态P相同,则a + b 的值是 。
24.(8分)氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35mL0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05mol/L KMnO4溶液16mL,恰好完全反应。
回答下列问题:
(1)配平: MnO4-+ H2C2O4+ H+― Mn2++ CO2↑+ H2O
(2)0.05mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为 。
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)。
23.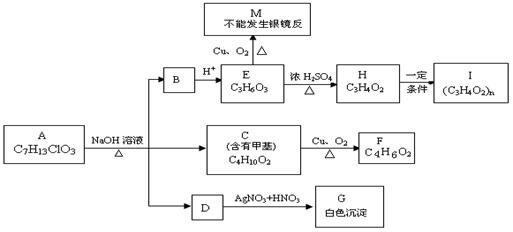 (10分)从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
(10分)从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
(1)A的结构简式: ;
(2)写出反应类型: E→H 、H→I ;
(3)写出C→F的化学方程式: 。
(4)请设计出由丙烯合成CH3-CH(OH)-COOH的反应流程图(有机物用结构简式表示,必须注明反应条件)。提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:


 B
C
……
G
B
C
……
G
22.(8分)现有A、B两种有机化合物,已知:①它们的分子中含有相同数目的碳原子和氧原子,B可以看成A中一个氢原子被氨基取代得到;②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;③它们都是一取代苯,分子中都没有甲基,都有一个羧基。请按要求填空:
⑴A、B的分子中氢元素的质量分数都是_________________;
⑵A的结构简式是___________________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官能团不直接与苯环相连,C的结构简式是_____________________________;
⑷B有一同分异构体D是苯环上的一硝基化合物,其苯环和侧链上的一溴代物各有两种,D的结构简式是____________________________________________。
21.(10分)2007年3月,温家宝总理在十届人大五次会议上指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 。
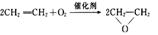 A.制备环氧乙烷:
A.制备环氧乙烷:

 B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
C.制备甲醇: 2CH4+O2 2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 ,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 。
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源生产工艺
|
|
原料生产工艺过程 |
|
乙炔 |
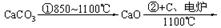 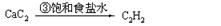 |
|
乙烯 |
来源于石油裂解气 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
20.(10分)已知A-L所代表的物质(溶液中的溶质),除B外均是中学化学里常见的物质,它们的转化关系如图所示。(反应时加入或生成水均略去)已知:a.通常状况下,A是淡黄色固体,C是红棕色固体,D是气体单质,E是无色无味气体;b.反应②-③是工业生产L的部分反应,反应④是工业生产普通玻璃的反应之一;c.B是由两种元素组成的化合物,其质量比为7:5;请填写下列空白:

(1)A的电子式 ,B的化学式 。
(2)反应②的工业生产条件 ,
写出工业生产L时反应①的设备名称 。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式: ,
②反应④的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com