
题目列表(包括答案和解析)
33、(06天津理综28)(19分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
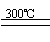 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000-1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量
SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:
_______________________________ 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
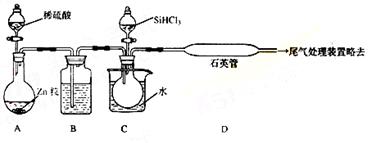
①装置B中的试剂是_______________________________ ,装置C中的烧瓶需要加热,其目的是:
_______________________________ 。
②反应一段时间后,装置D中观察到的现象是_______________________________ ,装置D不能采用普通玻璃管的原因是 _______________________________,装置D中发生反应的化学方程式为 _____________________________ 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 _______________________________ 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a碘水 b氯水 cNaOH溶液 d KSCN溶液 eNa2SO3溶液
31.(2006惠州一模)某结晶水合物含有两种阳离子和一种阴离子。称取质量为1.96 g的该结晶水合物,配成溶液。加入足量Ba(OH)2溶液并加热该混合物,生成白色沉淀,随即沉淀变为灰绿色,最后变成红褐色,标况下产生224 mL能使湿润的红色石蕊试纸变蓝的气体;将沉淀过滤、洗涤并灼烧至恒重,得到固体粉末2.73 g;用足量稀盐酸处理上述粉末,洗涤和干燥后得到白色固体2.33 g。
请回答:
(1)该结晶水合物含有的两种阳离子是__________和__________,阴离子是__________。
(2)试通过计算确定该结晶水合物的化学式。
32(06全国理综I 28)(15分)
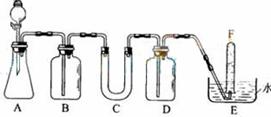
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的学化试剂和实验用品。用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
⑴A是制取CO2的装置。写出A中发生反应的化学方程式 _______________________________
⑵填写表中空格
|
仪器 |
加入试剂 |
加入试剂的目的 |
|
B |
饱和NaHCO3溶液 |
|
|
C |
|
|
|
D |
|
|
⑶.写出过氧化钠与二氧化碳反应的化学方程式_______________________________
⑷.试管F中收集满气体后,下一步实验操作是_______________________________
30.(2007扬州一模)茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500 g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6-7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入7.95 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.1000 mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00 mL,计算结果。请回答下列问题
步骤 1中,使茶叶灰化需要三角架、泥三角、酒精喷灯、_________、_________等仪器。
步骤2中,改用试剂________________来调节pH将更为方便;判断沉淀已经洗涤干净的方法是
______________________________________________________________。
步骤3中,滴定操作时,眼睛注视________________________。被滴定的20 mL滤液中 CO32-的物质的量为_________mol,原茶叶中钙离子的质量分数为________________。若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,则测得的钙离子的质量分数将__________(填下列序号之一:①偏小 ②偏大 ③不偏 ④偏小或偏大或不偏)
29.(2006淮安二模)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)不用普通滤纸过滤器过滤KMnO4溶液的原因是___________________________________;
(2)如何保证在700C-800C条件下进行滴定操作:______________________________;
(3)准确量取一定体积的KMnO4溶液用________________;
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用___________(填序号);
A.H2C2O4•2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
(5)若准确称取W g,你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。问:
①滴定终点标志是________________________;②KMnO4溶液的物质的量浓度为_____________ mol·L-1;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将________(填“偏高”或“偏低”)
28.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将PH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
 (2)下列实验没有错误的是
(2)下列实验没有错误的是
(3)下图为常见仪器的部分结构(有的仪器被放大)
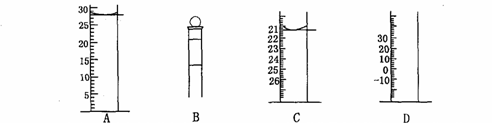
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
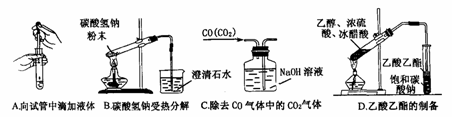
27.(06南京一模)(1)下列四种实验装置(根据需要可在其中加入液体或固体)
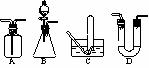 ①能用于干燥二氧化硫气体的装置有________(填字母)。
①能用于干燥二氧化硫气体的装置有________(填字母)。
②装置B除可用于制取CO2、H2,还可制取_____、_____。(写出两种物质的化学式)。
③既能用于收集氯气又能用于收集一氧化氮气体的装置有_____。(填字母)
26.(2007广东省一模)(1)下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙,常用于物质分离的是____________(填编号)。
(2)从草木灰中提取钾盐的实验操作顺序如下:
①称量样品 ②溶解沉降 ③____________ ④____________ ⑤冷却结晶。
(3)某同学为验证苯的沸点(80.1℃)比水低,以试管取用少量的苯放在水浴中,并在水浴中插一温度计。实验开始后,用酒精灯给水浴加热。该实验有一个明显的缺点是什么?___________________________,你的改进方案是_______________________________________________________________________________________。
25.按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,
 则X气体可能是 [ ]
则X气体可能是 [ ]
A.CH3CH2OH(气)
B.CO和H2
C.NH3
D.H2
24.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的有[ ] (双选)
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了自身氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
23. .如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,
.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,
打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合一定不可能是下列的 [ ]
A.氢氧化钠溶液、二氧化碳 B.水、氨气
C.氢氧化钠溶液、一氧化氮 D.水、二氧化氮
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com