
题目列表(包括答案和解析)
4.下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
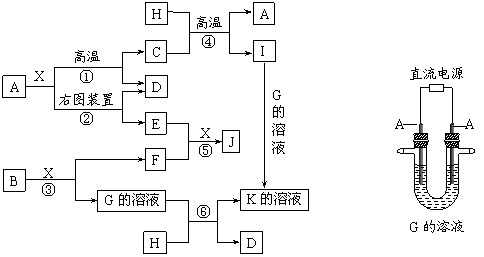 请按要求填空:
请按要求填空:
⑴写出B的电子式:______________________。
⑵写出生成E的电极反应式:______________________________________,反应⑤的现象是______________________________________。
⑶反应①的化学方程式是_____________________________________________,在实验室中引发反应④的操作是__________________________________________。
⑷反应⑥的离子方程式是_____________________________________________。
3.甲、乙、丙是三种常见的单质;A、B、C均是由两种元素组成中学化学中常见的无机物;上述物质间存在如下图所示转化关系(反应条件未注明)。
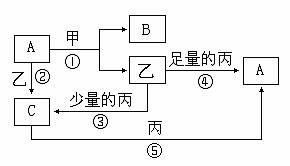 回答下列问题:
回答下列问题:
⑴若反应①中甲是常见金属,乙是常见非金属固态单质,则A的结构式是 ,
B的电子式是 ,C在日常生活中的用途是 。
⑵若反应①中甲是常见非金属气态单质,丙是常见金属,甲由短周期元素组成,乙与甲同主族、与丙同周期,且反应①、②、⑤通常在溶液中进行。请写出下列化学反应的离子方程式:
反应①: ;
反应②: ;
反应⑤: ;
2.已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
 请填写下列空白:
请填写下列空白:
⑴反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为:
。
⑵从D溶液制备D的无水晶体的“操作a”为 。
⑶反应②的化学方程式为 。
⑷反应⑤的化学方程式为______________________________________________。
⑸原电池反应①中正极的电极反应式为 。
1.有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:

请填写下列空格:
⑴甲的浓溶液与一种黑色粉末共热可得A,工业上保存A的方法为:
__________________________________________________________。
⑵写出下列化学用语:
用电子式表示乙分子的形成过程__________________________________________,
戊分子的结构式是______________,甲和丙反应产物的电子式 _______________。
⑶写出下列反应的化学方程式:
丙+丁→D + 乙:_____________________________________________
A+丙→D + 甲:_____________________________________________
5.根据特征数据推断
近两年计算型推断题成为高考热点之一
①解这类题时要善于抓住物质转化时相对分子质量的变化(例CO→CO2,NO → NO2,SO2→SO3转化时分子中都增加1个氧原子,相对分子质量变化均为16);
②放出气体的体积或生成沉淀的量;
③化合物中各元素的含量;
④气体的相对密度、相对分子质量;
⑤离子化合物中离子个数比;
⑥反应物之间的物质的量比;
⑦电子总数、质子总数等重要数据。
专题练习
4.根据特殊工业生产推断
重要工业生产反应(回忆重要的工业过程)
⑴煅烧石灰石(工业上制取生石灰,副产物为CO2)
⑵煅烧黄铁矿 ⑶二氧化硫的催化氧化(工业上制硫酸,请关注反应的热效应、反应设备、厂址的选择、三废的利用等问题、反应条件的选择)
⑷合成氨
⑸氨的催化氧化(用于硝酸工业,知识个极为典型的连续反应工程应特别予以关注)
⑹电解饱和食盐水
⑺工业制盐酸
⑻工业制取漂粉精
⑼工业制水煤气
⑽硅酸盐工业
3.根据特征转化关系推断
⑴掌握一些特别的连续变化关系
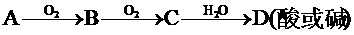
①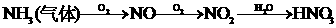
②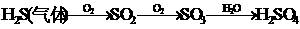
③
④
⑵注意几个典型转化关系
三角转化:
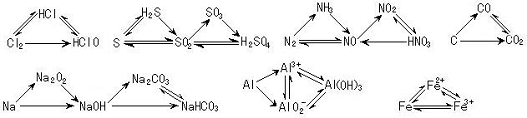
⑶与碱反应产生气体
①
②铵盐: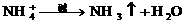
③既能与酸反应又能与碱反应
单质:Al
化合物:Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸
A- 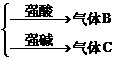
A为弱酸的铵盐如(NH4)2CO3或NH4HCO3;(NH4)2S或NH4HS;(NH4)2SO3、NH4HSO3
④与酸反应产生气体


⑤Na2S2O3与酸反应既产生沉淀又产生气体:S2O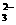 +2H+=S↓+SO2↑+H2O
+2H+=S↓+SO2↑+H2O
⑥与水反应产生气体
单质
化合物
⑦强烈双水解

⑧与Na2O2反应
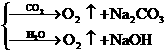
⑨电解

其他反应
铝热反应:Al+金属氧化物 金属+Al2O3
金属+Al2O3
归中反应:2H2S+SO2=3S+2H2O 4NH3+6NO 4N2+6H2O
4N2+6H2O
ClO-和ClO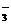 和Cl-在酸性条件下的归中反应
和Cl-在酸性条件下的归中反应
置换反应:
金属→金属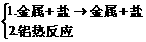
金属→非金属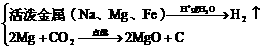
非金属→非金属
非金属→金属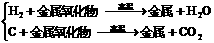
受热分解产生2种或3种气体的反应:
铵盐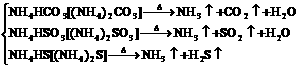
硝酸盐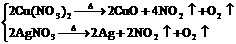
无机框图中常用到催化剂的反应:
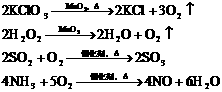
N2+3H2 2NH3
2NH3
2.根据特征反应现象推断
特征反应现象:
⑴焰色反应:Na+(黄色)、K+(紫色)
⑵使品红溶液褪色的气体:SO2 (加热后又恢复红色)、Cl2(加热后不恢复红色)
⑶白色沉淀Fe(OH)2置于空气中最终转变为红褐色[Fe(OH)3](由白色→灰绿→红褐色)
⑷在空气中变为红棕色:NO
⑸气体燃烧呈苍白色:H2在Cl2中燃烧;在空气中点燃呈蓝色:CO、H2、CH4
⑹使湿润的红色石蕊试纸变蓝:NH3
⑺使湿润的淀粉碘化钾试纸变蓝:Cl2、Br2、FeCl3、碘水等(即只要有能力将I-氧化为I2分子,不一定是碘分子)
1.根据物质的特殊颜色推断
物质颜色
⑴有色固体:
红色:Cu、Cu2O、Fe2O3
红褐色:Fe(OH)3
黄色:AgI、Ag3PO4
浅黄色:S或Na2O2或AgBr 蓝色:Cu(OH)2 紫黑色:KMnO4、I2
黑色:炭粉、CuO、FeO、FeS、CuS、Ag2S、PbS;
白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3;
⑵有色溶液:
Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO (紫红色)、Fe(SCN)3(血红色)
(紫红色)、Fe(SCN)3(血红色)
|
|
水(溶剂) |
苯(溶剂) |
CCl4(溶剂) |
|
Br2 |
黄→橙 |
黄→橙红 |
|
|
I2 |
深黄→褐 |
淡紫→紫红 |
紫→深紫 |
说明:表格中的溶液基本随着溶液浓度的升高而接近单质本身的颜色
⑶有色气体:
Cl2(黄绿色)、Br2(g)(红棕色)、NO2(红棕色)、I2蒸气(紫色)、O3(淡蓝色)
16.下列有关说法中,错误的是
A.NH4H是一种离子晶体,其中氢离子的核外电子排布与氦原子相同
B.在石墨晶体中,碳原子与共价键的个数比为2:3
C.三种氢化物的沸点高低:HBr>HCl>HF
 D.CaC2的电子式为
D.CaC2的电子式为
17 下列物质有固定的熔点,且熔点逐渐降低的一组物质是
A.HI、HBr、HCl、HF B.石英、食盐、干冰、钾
C.重油、柴油、煤油、汽油 D.KI、I2、Hg、O2
18 下列物质性质变化规律正确的是
A.金属Na、Mg、Al的硬度依次降低 B.HI、HBr、HCl、HF的沸点依次降低
C.干冰、钠、冰的熔点依次降低 D.O、F、H的原子半径依次减小
19下列说法中正确的是
A.C60气化和I2升华克服的作用力相同
 B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.氯化钠和氯化氢溶于水时.破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
20 已知如图CsCl晶体的密度为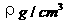 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
A. 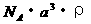 B.
B.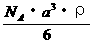 C.
C. 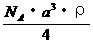 D.
D.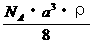
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com