
题目列表(包括答案和解析)
2.下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)=C(金刚石);ΔH= +119 kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);ΔH= -285.8 kJ/mol
1.在101kPa和25℃时,有反应的热化学方程式:
H2(g)+ O2(g)=H2O(g);ΔH = -241.8kJ/mol
O2(g)=H2O(g);ΔH = -241.8kJ/mol
H2(g)+ O2(g)=H2O(l);ΔH = -285.8kJ/mol
O2(g)=H2O(l);ΔH = -285.8kJ/mol
下列说法中错误的是
A.H2燃烧生成1mol H2O(g)时,放出241.8 kJ的热量
B.H2的燃烧热为285.8 kJ
C.O2前面的1/2表示参加反应的O2的物质的量
D.1 mol液态水变成水蒸气时吸收44kJ的热量
22. 下列每一方框中的字母代表某物质或其溶液,其中A为常见的气态氧化物,B为液态非金属单质,E、F为常见金属单质,I和M两溶液反应后可生成胶状白色沉淀,各物质有如下转化关系:
下列每一方框中的字母代表某物质或其溶液,其中A为常见的气态氧化物,B为液态非金属单质,E、F为常见金属单质,I和M两溶液反应后可生成胶状白色沉淀,各物质有如下转化关系:
试填写下列空白:
⑴B的化学式为 ,F的化学式为 ;
⑵E 和氧化物G反应的化学方程式为 ;
⑶C和D在一定条件下可反应生成A和B,其反应的化学方程式为
。
21.已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答:
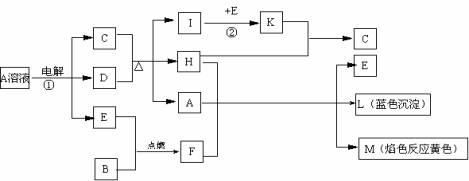
⑴L的化学式: F的电子式: 。
⑵反应①的离子方程式: 。
⑶反应②,工业上采取的反应条件: 。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
。
20.A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态.其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合.有关的转化关系如下图所示(反应条件均已略去).

回答下列问题:
⑴A的化学式为_______________;
⑵写出反应③的化学反应方程式___________________________________________;
⑶Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为_____________________________________;
⑷将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023个,则参加反应的E的质量为________g;
⑸将Z与N反应后的产物溶于水中,则溶液的pH(填“<”或“>”)________7,其原因是________________________________________________________________。
19.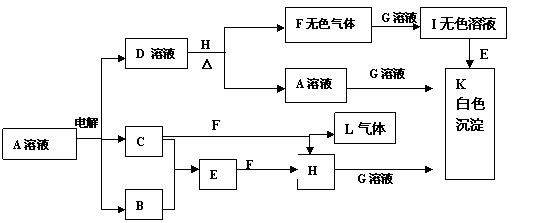 A、B、C、D、E、F、G、H、I、J、K、L是中学里常遇到的一些物质,它们之间有如下的转化关系,有些必要的信息已在图框中注明:
A、B、C、D、E、F、G、H、I、J、K、L是中学里常遇到的一些物质,它们之间有如下的转化关系,有些必要的信息已在图框中注明:
 回答下列问题:
回答下列问题:
⑴H的电子式为___________。⑵在实验室中收集气体B的方法是_ ___ ;
在实验室中制取气体C的化学反应方程式是 .
⑶写出下列各方程式:
C+F→H+L化学反应方程式:________________ ;
I+E→K的离子反应方程式: ______________________ 。
18.下图为一些常见物质的转化关系图。电解C溶液的反应是无机化工生产中的一种重要反应,Q、M为常见单质;F、L是含有同一种元素的化合物,该元素在两种化合物中的价态不同。
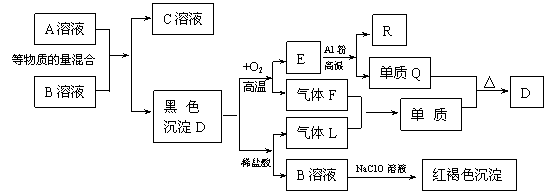
试回答下列问题:
⑴用化学式表示:B: D:
⑵完成下列反应的化学方程式:
①F+L=M+H2O 。
其中氧化产物与还原产物的物质的量比 。
②电解C的饱和溶液(用单线桥法表示其电子转移的方向和数目)
。
⑶写出R与NaOH溶液反应的离子方程式
。
17. 下图中A-G是化合物,H是一种无色气态单质,D常温下是一种无色液体,它们有如下转化关系:
下图中A-G是化合物,H是一种无色气态单质,D常温下是一种无色液体,它们有如下转化关系:
⑴写出A的名称: ;B分子的空间构型为: ;C结构式: ;
⑵C与E反应的化学方程式: ;
⑶写出少量A溶液与足量F的浓溶液反应的离子方程式:
。
16.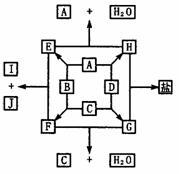 下边物质转化图中,A、B、C、D是周期表短周期元素组成的单质,A的组成元素的原子的次外层上只有2个电子,其最高氧化物的水化物是一种强酸。B、C的组成元素属同一主族。J、G分别是C的组成元素的最高价态和最低价态的化合物。冷凝E可使气体的颜色变浅。
下边物质转化图中,A、B、C、D是周期表短周期元素组成的单质,A的组成元素的原子的次外层上只有2个电子,其最高氧化物的水化物是一种强酸。B、C的组成元素属同一主族。J、G分别是C的组成元素的最高价态和最低价态的化合物。冷凝E可使气体的颜色变浅。
⑴分别写出A、B、C、D的化学式:
A为___ ________;B为____ ____;C为________;D为______ __.
⑵写出生成I和J的化学方程式___________ _ __.
⑶E、F、G、J四种物质氧化性由强到弱的顺序是______ ________.
15.已知A-L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质。通常状况下,A、B均是淡黄色固体,D是气体单质,E是无色无味气体,K是不溶于水的酸。反应①-③是化学工业生产重要产品的全部反应,反应④是工业生产普通玻璃的反应之一。一定条件下,各物质间的相互转化关系如下图所示(反应时加入或生成的水均没标出)。

请填写下列空白:
⑴写出下列物质的化学式:B_________;D的同素异形体_________。(均填化学式)
⑵画出A中金属元素的原子结构示意图_____________;指出E分子中共价键的类型(填“极性键”或“非极性键”)____________。
⑶指出反应①②③是吸热反应,还是放热反应?____________。
⑷完成下列反应方程式:
①I+G→M+L的离子方程式:______________________________________________。
②写出反应④的化学方程式:_____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com