
题目列表(包括答案和解析)
8.相同条件下,下列装置中指定电极的电极反应式相同的是( )
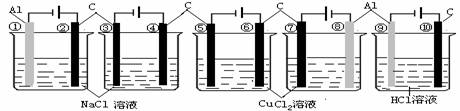
A.②④⑥⑦⑩ B.①③⑤⑧⑨ C.②③④⑤⑥⑦⑩ D.①③⑤⑦⑨
7.己知 CuS04 溶液分别与 Na2C03 溶液、 Na2S 溶液的反应情况如下 :
(1) CuS04 十 Na2C03 主要 : Cu2+ + C032- H20 ==CU(OH)2 ↓十 CO2 ↑
次要 : Cu2+ + C032- == CuC03 ↓
(2) CUS04 +Na2S 主要 : Cu2+ +S2- == CuS ↓
次要 : Cu2+ + S2- +2H20==Cu(OH)2↓+ H2S ↑
下列几种物质的溶解度大小的比较中 , 正确的是
A. CuS <Cu(OH)2<CuC03 B. CuS >Cu(OH)2>CuC03
C. Cu(OH)2>CuC03>CuS D. Cu(OH)2<CuC03<CuS
6. 目前人类已发现的非金属元素除稀有气体外 , 共有 16 种 ,下列对这16种非金属元素的相关判断:
①都是主族元素 , 最外层电子数都大于4 ②单质在反应中都只能作氧化剂
③氧化物常温下都是气态 , 所以又叫都气态氢化物 ④氧化物常温下都可以与水反应生成酸
A 有①②正确 B. 只有①③正确 C. 只有③④正确 D. ①②③④均不正确
5.测定相对分子质量的常用方法之一是凝回点下降法。例如水是常用的溶剂 , 当水中溶解了某种不挥发的溶质时 ,水的凝固点 (即冰点) 即会下降 , 海水在 0℃时不会结冰就是这个原因。凝固点下降的程度与溶质的分子数有关 ,而与溶质是何种物质无关 , 这就是溶液的依数性。当溶剂的量确定时 , 凝固点的降低值与溶质分子数成正比。己知 10.0 g 樟脑中溶解 0.412 g萘 , 凝固点下降了13 °C, 即么 , 组成为 C7H602 的有机物 0.23g 溶于 15.6 g 樟脑中 , 凝固点下降约多少 ( 己知萘相对分子质量为 : 128)
A.5 ℃ B.8℃ C.7℃ D.12℃
4.设NA代表阿佛加德罗常数的数值,下列说法中正确的是
①常温常压下,17g甲基(-14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
3.某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据:
|
硫酸铜溶液 |
① |
② |
③ |
④ |
|
加入的无水硫酸铜(g) |
2.50 |
5.00 |
8.00 |
11.0 |
|
析出的硫酸铜晶体(g) |
0.10 |
4.60 |
10.0 |
15.4 |
当加入5.60 g 无水硫酸铜时,析出硫酸铜晶体的质量为
A. 3.88 g B.5.32 C.5.68 g D.6.82 g
2.右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是
A.b、c、e三种元素的单核离子半径大小关系: e>b>c
B.六种元素中,d元素的性质最稳定
C.c的氢化物沸点比f氢化物的沸点低
D.b元素除0价外,只有一种化合价
1.我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。下列说法正确的是 ( )
A.“钴酞菁”的小分子具有胶体的性质
B.纳米材料可以应用于所有化工领域
C.现在纳米器件都是无所不能的胶体
D.此工作实现了利用局域的化学反应来改变和控制分子的物理性质
4、2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子--丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
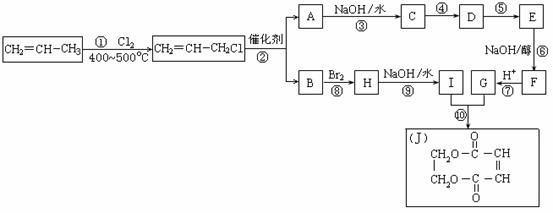
请按要求填空:
(1)写出下列反应的反应类型:
①:______________,⑥:______________,⑧:______________。
(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一
步反应的目的是______________________________________________,物质E的结构
简式是_______________________。
(4)反应⑩的化学方程式是___________________________________________。
3、铍是金属中最好的良导体。因它有极好的吸热、散热性能,故有许多超音速飞机的制动装置是用铍来制造的。当人造地球卫星和宇宙飞船穿上铍的“防热外套”时,能够及时吸收因穿越大气层摩擦而产生的热量并很快的散发出去,从而保障飞船的飞行安全。
铍还是高效率的火箭燃料,铍在燃烧时能释放出巨大的能量:每kg的铍完全燃烧放出的热量为62700kJ。
另外,几乎各种各样的原子反应堆都要用铍做中子反射体。要建设一个大型的原子反应堆,往往需要动用2吨金属铍。
(2)有些物质如B(OH)3(硼酸)、Al(OH)3中心原子是缺电子的,他们的最外层电子数都不满8个电子。在水中也有一定的酸性,但不是本身电离出H+,而是靠夺取水中的OH-使水电离出H+从而使溶液呈现酸性。如:
B(OH)3+H2O= B(OH)4-+H+ ;Al(OH)3+H2O= Al(OH)4-+H+
根据上述信息,请回答下列问题:
①铍的燃烧热是 。
②氧化铍、氢氧化铍性质类似于氧化铝、氢氧化铝,则氧化铍为 氧化物(填“酸性”或“碱性”或“两性”)。
③如果氢氧化铍与碱反应生成的阴离子中铍原子最外层电子数满足8电子结构,试写出氢氧化铍与氢氧化钠溶液反应的化学反应方程式: 。
④写出氧化铍与盐酸反应的离子反应方程式: 。
⑤能有效除去水中铍离子的试剂是: 。
A、氨水 B、碳酸钠溶液 C、稀硫酸 D、氢氧化钠溶液
答案:(1)564.3KJ·mol-1 (2)两性
(3)Be(OH)2+2OH-=Be(OH)42- (4)BeO+2H+=Be2++H2O
(5)B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com