
题目列表(包括答案和解析)
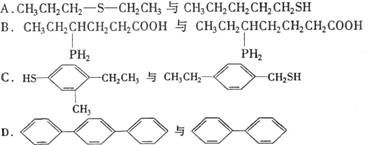
4.下列各组有机物中,既不互为同系物,又不互为同分异构体的是 ( D )
3.若液氨相当于地球上的水,它可满足木星上生物生存的需要,那么木星上生物体内与地球上生物体内葡萄糖的分子结构相当的化合物是 ( )
A.CH2OH-(CHOH)4CHO B.CH2NH2-(CHNH2)4CHO
C.CH2NH2-(CHNH2)4CH=NH D.CH2OH-(CHOH)4CH=NH
2.生活中的一些问题常涉及化学知识,下列叙述不正确的是 ( )
A.糯米中的淀粉一经发生水解反应,就酿造成酒
B.福尔马林是一种良好的杀菌剂,但不可用来消毒饮用水
C.棉花和人造丝的主要成分都是纤维素
D.室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染空气
1.“喷水溶液法”是最近日本科学家研制出的一种使沙漠变绿洲的新技术,它先在沙漠上喷洒一定量聚丙烯酯水溶液,水溶液中高分子与沙土粒子结合,在地表下30-52cm处形成一厚0.5cm的隔水层,既能阻止地下的盐分上升,又有在表层蓄积雨水的作用。下列对聚丙烯酸酯的说法不正确的是 ( )
A.单体的结构可表示为 CH2=CHCOOR B.在一定条件下能发生加成反应
C.在一定条件下能发生水解反应 D.没有固定的熔沸点
5、某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
Ⅰ.(1) 某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂
是_______________,反应的离子方程式为_________________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
 Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸
的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为______________________。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________;
上述现象说明溶液中________________结合OH-的能力比________强(填离子符号)。
(3) B与A的差值为_________mol。
(4) B点对应的沉淀的物质的量为______mol,C点对应的氢氧化钠溶液的体积为_____mL。
Ⅰ ⑴合理 ⑵NaOH溶液 2Al+2OH-+2H2O=2AlO2-+3H2↑ ⑶B
Ⅱ ⑴H++OH-=H2O ⑵ NH4++OH-=NH3·H2O Al3+、Fe3+、H+,NH4+;
⑶0.008 ⑷0.032mol 7mL
4、“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”。“烂版液”的主要成分是Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中,由“烂版液”制取ZnSO4·7H2O的过程如下:
① 在“烂版液”中逐渐加入6mol·L-1NaOH溶液,至pH=8为止。
② 过滤后得到Zn(OH)2沉淀,用去离子水多次洗涤沉淀。
③ 用2mol·L-1的硫酸,慢慢将洗净的Zn(OH)2溶解,保持一定的pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
④ 溶液中注入2 mol·L-1的硫酸,使其pH保持为2……
⑴步骤①中控制溶液pH=8的操作是 ;步骤②中如何检验沉淀已经洗涤干净? 。
⑵步骤③中加热的目的是 ;趁热过滤的目的是 。
⑶将步骤④还缺少的操作是 ,所用的主要仪器是 。
答案:⑴用玻璃棒蘸取溶液,点滴在pH试纸中央,与标准比色卡对照 取最后一次洗涤液,滴加硝酸银溶液,若无白色沉淀,说明已经洗涤干净
⑵促使Fe3+完全水解 减少ZnSO4的损失,除去Fe (OH)3沉淀
⑶将溶液小心加热浓缩,冷却结晶 蒸发皿,酒精灯,铁架台,玻璃棒
4. (1)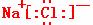 H-Cl (2)
2NaCl+2H2O=2NaOH+Cl2↑+H2↑、Al2O3+2OH-=2AlO2-+H2O
H-Cl (2)
2NaCl+2H2O=2NaOH+Cl2↑+H2↑、Al2O3+2OH-=2AlO2-+H2O
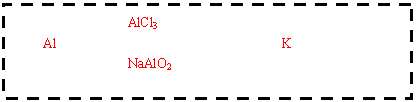 (3)
(3)

(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol
2、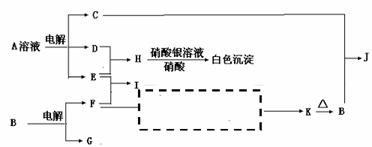 反应①②是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气体,F是常见的金属单质,G是空气中主要成分之一,K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A-J中的物质:
反应①②是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气体,F是常见的金属单质,G是空气中主要成分之一,K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A-J中的物质:
(1)A的电子式 ,
H的结构式是 ;
(2)A溶液的电解方程式是 ;
C+B→J的离子方程式是 ;
(3)请设计F→K的最佳途径

(4)按设计得到1mol K,电解B时转移的电子数目是 ,至少需要另加试剂的物质的量是
|
1、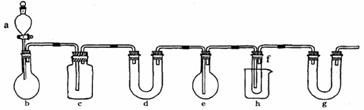 PCL3有毒,在潮湿的空气中可发生水解反应产生大量的白雾。它在实验室和工业上都有重要的应用。在实验室中可用下图所示装置(酒精灯、铁架台等未画出)制取PCL3,在圆底烧瓶e中放入足量白磷,将CL2迅速而有不间断地通入e中,氯气与白磷会发生反应,产生火焰。
PCL3有毒,在潮湿的空气中可发生水解反应产生大量的白雾。它在实验室和工业上都有重要的应用。在实验室中可用下图所示装置(酒精灯、铁架台等未画出)制取PCL3,在圆底烧瓶e中放入足量白磷,将CL2迅速而有不间断地通入e中,氯气与白磷会发生反应,产生火焰。
|
|
熔点 |
沸点 |
|
三氯化磷 |
-112℃ |
76℃ |
|
五氯化磷 |
148℃ |
200℃分解 |
三氯化磷和五氯化磷的物理常数如下:
图中a、b应该装入的试剂或药品分别是浓盐酸和二氧化锰,并在b仪器处加热。请据此回答下列问题:
(1)写出b中发生反应的化学方程式:_____________。
(2)氯气和白磷反应放出大量的热,为使仪器e不致因局部过热而炸裂,实验开始前应在e的底部放少量_______。
(3)在烧杯h中加入冰盐水,其作用是_________________________________。
(4)C中所盛装的试剂是_______,其作用是_______________________________。
(5)实验室将白磷保存于水中,取出的白磷用滤纸初步吸去表面水分,然后浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知酒精与乙醚互溶,乙醚易挥发。用上述方法除去水分的原因是____________________。
(1)4HCl(浓)+MnO2====MnCl2+Cl2↑+2H2O(2)细沙(3)冷凝PCl3蒸气(或使三氯化磷蒸气充分冷凝)
(4)饱和NaCl溶液;吸收Cl2的HCl气体 碱石灰;防止空气中水蒸气进入e中使PCl3水解,同时吸收Cl2防止污染空气(5)白磷上残留的水溶解在酒精中,残留的酒精又溶解在乙醚中,乙醚容易挥发,从而完全除去水分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com