
题目列表(包括答案和解析)
6、⑴铝熔点较低先熔化,氧化铝熔点高未熔化而成膜状包裹着液态铝;
⑵4Al(s)+3O2(g)==2Al2O3(s);△H=-1670Kj/mol;
⑶Mg+Cu2+==Mg2++Cu,2H2O+Cu2+==Cu(OH)2+2H+,Mg+2H+==Mg2++H2,Cu(OH)2+Mg2+==Mg(OH)2+Cu2+
⑷O2+2H2O+4e-==4OH- ⑸①2Al+6H+==2Al3++3H2
②假设a:Cl-对反应有催化作用,加快了反应速率;
假设b:SO42-对反应有阻碍作用,降低了反应速率。
③ a、取体积相同、c(H+)相同的稀硫酸溶液于两支试管中,向其中一支加少量氯化钠固体,然后同时投入两片质量相等、表面积相同的铝片,收集相同时间段内氢气,比较其体积的多少。b、取体积相同、c(H+)相同的稀盐酸于两支试管中,向其中一支加少量硫酸钠固体,然后同时投入两片质量相等、表面积相同的铝片,收集相同时间段内氢气,比较其体积的多少。
④
|
编号 |
措施 |
|
1 |
在稀硫酸中加少量氯化钠固体 |
|
2 |
在稀硫酸中加少量硫酸铜固体 |
|
3 |
适度增大稀硫酸的浓度 |
|
4 |
适度升高稀硫酸的温度 |
课后作业答案:
5、①选B项。②选B项。 ③选A项。 ④因分子中含苯环,故能发生硝化反应 ⑤“摇头丸”在加热加压和有催化剂时跟H2反应的方程式:
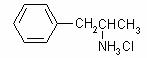 ⑥:
⑥:
4、(1)易。强还原性。NaHSO2·CH2O+2I2+2H2O?4HI+NaHSO4+CH2O。(2)
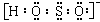 。(3)HSO2-+OH-=H2O+SO22-。(4)蛋白质。(5)聚甲醛。 C6H12O6。
。(3)HSO2-+OH-=H2O+SO22-。(4)蛋白质。(5)聚甲醛。 C6H12O6。
3、⑴B;⑵否,因为在吹出之前溴含量较低,用萃取剂进行萃取,效率低低下;
⑶①工厂、学校、村庄等;②在实验室装满一集气瓶饱和溴化钠溶液,到工厂周围把液体倒出,盖上盖玻片,带回实验室;
⑷3Br2+3CO32-==5Br-+BrO3-+3CO2 5Br-+BrO3-+6H+==3Br2+3H2O ;H2和Mg(OH)2
⑸NaXO具有氧化性,能把结构CH3CHOH-氧化成CH3CO-,从而发生卤仿反应
2、(1)C (2)PdH0.8(若写出Pd5H4给1分)(3)略(4)①不正确,水分子中不含氢分子,不可能在不发生化学反应的情况下得到氢气,且水分解是吸热反应(或③不正确,催化剂不能使化学平衡发生移动,故不能提高水分解产生氢气的转化率)
1、(1)①督促政府加强环保措施,增强政府工作透明度(1分),增强环保意识,给市民生活提供指导(1分)②CaCO3 CaO+CO2↑,CaO+SO2=CaSO3,
CaO+CO2↑,CaO+SO2=CaSO3,
2CaSO3+O2=2CaSO4
(2)①C(2分) ②控制机动车数量;改变机动车燃料,例如用太阳能或燃烧电池;改变机动车结构,使燃烧充分;增加机动车尾气吸收装置(2分)
(3)HCHO+4ClO-+4H+=CO2↑+2Cl2↑+3H2O(2分)
9、长期以来一直认为氟的含氧酸不存在。但是之1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。
⑴以下两种结构式,能正确表示次氟酸结构的是 ,理由是 。
A.H-O-F B.H-F-O
⑵次氟酸中氧元素的化合价为 ,次氟酸的电子式为 ,次氟酸分子中共价键的键角 180°(填“<”或“=”)
|
|
H2 |
O2 |
F2 |
OH |
OF |
HF |
|
E/(kJ/mol) |
432 |
494 |
155 |
424 |
220 |
566 |
⑶下面给出几个分子和基团化学键键能:
请计算反应:2HOF=2HF+O2的反应热
(△H)的近似值为 kJ/mol。
请从计算结果预测次氟酸的一条化学性质: 。
⑷次氟酸刹那间能被热水所分解,生成一种常见的物质M,该物质既表现有氧化性(对于碘化钠),又表现有还原性(对于高锰酸钾),则M的化学式为 ,写出次氟酸与热水反应的化学方程式: 。
⑸写出能够加快M分解的两种催化剂 和 (写化学式)。
★10、我们知道自然界中的蜘蛛丝和细菌纤维素纤维是典型的纳米纤维。较细的蜘蛛丝直径还不足100纳米,是真正的天然纳米纤维。美国与加拿大的科学家合作,采用蜘蛛基因,利用仿生结构,成功地纺制出人造蜘蛛丝,其强韧性能优于钢材。
⑴纳米纺织材料凭借其内部所特有的小尺寸效应、表面效应等日益受到广大消费者
的喜爱。许多纳米材料的粒子直径都在1-100nm之间,从分散系的角度看应该属于
⑵ 纳米是长度单位,物质的颗粒达到纳米级时,具有不同的性质,如果单质铜制成
“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,下列对“纳米铜”的说法正确的是: (填序号) A.“纳米铜”与铜片还原性相同
B.“纳米铜”比铜片更易失电子 C.“纳米铜”比铜片的氧化性强
⑶钢铁在人们生活中应用非常广泛,但是钢铁因腐蚀造成的损失全球每年高达7000
亿美元,目前钢铁被腐蚀的主要形式是吸氧腐蚀,其正极发生 反应,负极发生的电极反应式为 。为了减少这种腐蚀生产生活中常见的有哪些防腐措施: 。(至少填两种措施)
★11、20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染的反应途径。
(1)下列各项属于“绿色化学”的是
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)一氧化氮是大气污染物之一,它对环境造成的主要危害有 (填一
种)。目前,有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨把一氧化
氮还原为氮气和水。请写出该反应的化学方程式 ;
(3)三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度
时,它发生如下分解:C3N3(OH)3=3HNCO(异氰酸,其结构式为H-N=C=O)
① 三聚氰酸的分子结构中存在类似于苯环结构的六元环,则三聚氰酸的结构简式为 ;
② 氰酸是一种链状分子,它是异氰酸的同分异构体,其分子内各原子最外层均已达到稳定结构,则氰酸的结构式为 ;
③异氰酸能和NO2反应生成N2、CO2和H2O,在此反应中 化合物中
元素被氧化,写出该反应的化学方程式并标出电子转移的方向和数目:
有关化学与社会、能源、环境的专题训练
经典题型答案:
7、已知常温下苯酚微溶于水,溶解度为8.2g/100gH2O,其饱和溶液的物质的量浓度约为0.8mol·L-1,为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两个同学分别设计了如下实验方案:
甲:向两只试管中,分别注入0.8mol·L-1的乙醇和苯酚溶液3mL,各放入一小块金属钠,观察反应产生H2的速率。
乙:在两只试管中,分别放入1g乙醇和苯酚晶体,各注入3mL蒸馏水,振荡,得到乙醇溶液和苯酚悬浊液,再向两试管中逐滴加入5mol·L-1NaOH溶液,观察其中的变化。
⑴苯酚溶液与钠反应的离子方程式为:
⑵对于甲、乙两个实验方案,它们能否达实验目的,理由是什么?
甲:
乙:
Ⅱ、在分析甲、乙两同学实验方案的基础上,丙同学进行了下列对比实验:在两只试管中,分别放入2g无水乙醇和苯酚晶体,用约60℃的水浴加热,待苯酚熔成液态后,再向两试管中各放入一小块金属钠。在乙醇中,钠块能与乙醇反应产生气体,约3min后钠块消失,溶液保持澄清,在苯酚中,钠块表面有少量气泡,约2min后出现少量白色悬浮物,10min后白色悬浮物充满苯酚熔融液,振荡后发现钠块尚未完全消失。
⑶丙同学的实验表明,苯酚熔融液与钠的反应速率不如无水乙醇与钠的反应快,其主要原因是由于 ,因此苯酚熔融液和无水乙醇与钠反应的有关事实
(填“能或不能”)作为判断分子里羟基上氢原子哪个更活泼的依据。
⑷请你设计一个探究苯酚和乙醇分子中羟基上氢原子活泼性的实验方案:
6、Ⅰ、实验室打开盛有浓盐酸的试剂瓶,瓶口立即产生大量的白雾;把盛有浓氨水的试剂瓶打开,在瓶口却看不到白雾。对此,甲、乙、丙三位同学分别提出了如下假设:
甲:NH3与水蒸气的结合能力不如HCl强,瓶口附近形成的氨水小液滴少,达不到肉眼可见的程度。
乙:浓氨水的挥发性不如浓盐酸强,瓶口附近空气中的NH3少,形成氨水小液滴少,产生的白雾达不到能被肉眼观察的程度。
丙:NH3的相对分子质量比HCl小,NH3的扩散速率比HCl快,由于挥发出的NH3快速地向四周扩散,形成的氨水小液滴不易集中,所以看不到白雾。
为了验证假设的正确性,三位同学在老师的指导下进行了下列实验:
如下图所示,取一根长50cm直径约为2cm的玻璃管,水平放置在实验桌上,在其两端分别塞入蘸有浓盐酸和浓氨水的棉花球,立即用橡皮塞塞紧两端。数分钟后,玻璃管中在距离浓盐酸一端约18cm处开始产生白烟。

⑴在进行上述实验之前,甲同学就发现自己假设中的错误,确定甲假设中错误的理由是:
⑵上述实验中白烟产生在离浓盐酸一端18cm处事实,说明 ,所以,关于浓氨水试剂凭口看不到白雾的原因, (选填“甲、乙或丙”)的假设是正确的。
Ⅱ、氯化铵除了用肥料外,也用在金属的焊接上,以除去金属表面的氧化物薄曾。最近,我国又有学者将氯化铵用于制备无水氯化镁,其流程为:

氯化铵的这两项用途也与上述中所观察到的现象密切相关,试回答下列问题:
⑶氯化铵的电子式为:
⑷在加热条件下氯化铵能除去金属表面氧化物的原因为:
⑸在制备无水氯化镁的过程中如果不添加一定量的氯化铵可能造成的结果为
5、下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后,分别变为Na2S4和NaBr。
⑴左、右储罐中的电解质分别为:左______________,右_____________。
⑵写出电池充电时,阳极和阴极的电极反应式。
阳极: ,阴极: 。
⑶写出电池充、放电的反应方程式: 。
⑷指出在充电过程中钠离子通过膜的流向: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com