
题目列表(包括答案和解析)
28.(13分)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
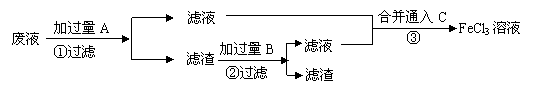
(1)写出一个证明还原性Fe比Cu强的离子方程式 ,该反应在上图步骤 中发生。请根据上
述反应设计一个原电池,在方框中画出简易装置图
(标出极名称、电极材料、电解质溶液)。
(2)分别写出上图步骤②、③相关反应的化学方程式:
步骤② 。
步骤③ 。
(3)上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应 。
27.(19分)28.(14分)(1) 下列有关实验操作或判断不正确的是 ______(填有关序号,选错倒扣分)。
A.用10 mL量筒量取稀硫酸溶液 8.0 mL B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
F.测定硫酸铜晶体中结晶水含量时,将加热后的坩埚置于干燥器中冷却后再称量
G.用冰醋酸,蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
 (2)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下: 2MnO4-+5C2O42-+16H+
(2)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下: 2MnO4-+5C2O42-+16H+ 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体。
②将W g Na2C2O4配成100 mL标准溶液,移取20.00 mL置于锥形瓶中,则酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中。
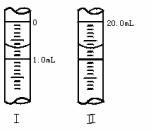
③若滴定管的起始读数和终点读数如右图所示,则酸性KMnO4的物质的量浓度为________ (填表达式)。
④若滴定完毕立即读数,测定的KMnO4溶液的浓度________(填“偏高”“偏低”或“不变”)。
26.(13分)对有机物A的组成、结构、性质进行观察、分析,得实验结果如下:
①A为无色晶体,微溶于水,易溶于Na2CO3溶液; ②完全燃烧166mg有机物A,得到352mgCO2和54mgH2O;
③核磁共振氢谱显示A分子中只有2种不同结构位置的氢原子; ④A的相对分子质量在100~200之间。
⑴A的分子式为 ,结构简式为 。
⑵A的一种同分异构体(与A具有相同的官能团),在一定条件下可发生分子内脱水生成一种含有五元环和六元环的有机物B,B的结构简式为 。
⑶A的某些同分异构体具有如下性质:a.能发生水解反应、b.能发生银镜反应、c.能使氯化铁溶液显紫色。则结构简式为 (至少写二种)。
13.已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2molSO2、1molO2,初始时两容器的温度、体积相同。一段时间后两容器中反应均达到平衡,为使两容器中SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
A.向甲容器中充入一定量的氦气 B.向乙容器中充入一定量的SO2气体
C.升高乙容器的温度 D.增大甲容器的压强
第II卷(非选择题共60分)
12.t℃时,在V mL密度为d g · cm – 3的FeCl3(相对分子质量为M)饱和溶液中,加入足量的NaOH溶液,充分反应后过滤(假设滤液无损失),在滤液中加入适量硝酸使溶液呈中性后,再加入4 mL 1.0 mol · L – 1的AgNO3溶液恰好完全反应,则t℃时FeCl3的溶解度为
A. B.
B.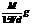 C.
C. D.
D.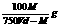
11.把a、b、c、d四块金属片浸入稀硫酸,分别用导线两两连接可以组成原电池.a、b相连时,a为负极;c、d相连时,电流方向为d→c;a、c相连时,c极产生大量气泡;b、d相连时,d极上发生氧化反应.这四种金属的活动性由强到弱的顺序是
A.abcd B.acdb C.cabd D.bdca
10.下列分离或除杂方法正确的是
A.乙烷中混有少量已烯,加溴水后分液 B.氢氧化钠中混有碳酸氢铵固体,直接加热分离
C.甲烷中混有少量二氧化硫,用酸性高锰酸钾溶液洗气
D.硝酸铁溶液中混有少量硝酸铜,加铁粉后重结晶
9.NA表示阿伏加德罗常数,下列叙述中正确的是
A.通常状态下,NH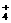 和NH
和NH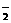 各1 mol含有的电子数均为10NA
各1 mol含有的电子数均为10NA
B.标准状况下当氧气与氦气的原子数均为NA时,它们具有相同的体积
C.在100 mL 1 mol · L – 1乙酸溶液中含乙酸的分子数为0.1 NA
D.1 mol 硫化氢在氧气中完全燃烧时,转移的电子数为2NA
8.百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式为: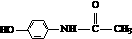 .下列有关该有机物叙述正确的是
.下列有关该有机物叙述正确的是
A.分子式为C8H10NO2
B.该有机物属于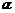 -氨基酸
-氨基酸
C.其属于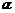 -氨基酸的同分异构体有3种 D.该有机物可与FeCl3溶液发生显色反应
-氨基酸的同分异构体有3种 D.该有机物可与FeCl3溶液发生显色反应
7.有一无色溶液,可能含有K+、Al3+、Mg2+、NH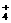 、Cl –、SO
、Cl –、SO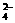 、HCO
、HCO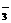 、MnO
、MnO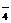 中的一种或几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生.下列推断正确的是
中的一种或几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生.下列推断正确的是
A.肯定有K+、HCO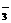 、MnO
、MnO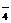 B.肯定有Al3+、Mg2+、HCO
B.肯定有Al3+、Mg2+、HCO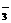
C.肯定有Al3+、Mg2+、SO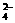 D.肯定有Al3+、Mg2+、NH
D.肯定有Al3+、Mg2+、NH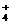 、Cl –
、Cl –
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com