
题目列表(包括答案和解析)
5.(05广东)Se是人体必需微量 元素,下列有关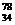 Se和
Se和 Se的说法正确的是
Se的说法正确的是
A、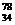 Se 和
Se 和 Se互为同素异形体
B、
Se互为同素异形体
B、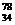 Se和
Se和  Se互为同位素
Se互为同位素
C、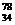 Se和
Se和  Se 分别含有44和46个质子 D、
Se 分别含有44和46个质子 D、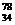 Se和
Se和  Se都含有34个中子
Se都含有34个中子
4.(2003江苏高考)下列各分子中所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D.PCl5
3.(2004上海)有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
2.(2004天津理综)核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有原子数或中了数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象:
A.18O 31P 119Sn
B.27Al 19F 12C
C.元素周期表中VA族所有元素的原子
D.元素周期表中第一周期所有元素的原子
1.(2003上海高考题)13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtǔWthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60 互为同素异形体
C.14N与15N互为同位素 D. 15N的核外电子数与中子数相同
3.命题趋向
原子结构和同位素的考点,常以重大科技成果为题材,寓较于考;化学键类型与晶体类型的判断、成键原子最外层8电子结构的判断、离子化合物和共价化合物的电子式、各类晶体物理性质的比较、晶体的空间结构等是高考的重点内容。
[专题训练A]
2.解题注意点
(1)原子的相对原子质量与元素的相对原子质量不同,后者该元素的各种同位素的相对原子质量的加权平均值。
(2)共价化合物中一定没有离子键,离子化合物中可能含有共价键。
(3)对不熟悉物质的晶体类型的判断,要根据物质的性质加以判断。
1.方法与技巧
(1)原子结构
构成原子和离子的各基本粒子之间的数量关系和原子的和外电子排布知识,是解决有关原子结构问题的基础,复习时应注意理解。
(2)分子结构
①简单分子结构的确定
简单分子的结构可根据最外层电子数和各种原子形成相对稳定的结构时所需形成的共用电子对数确定,也可结合分子中各元素的化合价加以确定。
②键的极性与分子极性
分子的极性由键的极性和分子的空间结构共同决定。对于ABn型分子,若中心原子A的化合价的绝对值等于该元素所在的主族序数,则该分子为非极性分子。
③分子中各原子是否满足8电子稳定结构的判断
一般地,在ABn型分子中,若“原子的最外层电子数+化合价的绝对值=8”,则分子中该原子最外层满足8电子稳定结构。
(3)晶体结构
掌握几种典型晶体(如氯化钠、氯化铯、金刚石、二氧化硅、干冰、石墨等)的空间结构特征,构成晶体的基本粒子及其相互间的作用力,每种晶体的主要物理性质。通过这些具体物质的“化学事实”解决其他类似晶体结构问题。
6.以上知识在高考命题中每年都有不同程度的体现。
[典型例题]
[例1]科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素
中最重的原子。关于该新元素的下列叙述正确的是
A.其原子核内中子数和质子数都是112
B. 其原子核内中子数为165,核外电子数为112
C.其原子质量是12C原子质量的277倍
D. 其原子质量与12C原子质量之比为277:12
[备选]同温同压下,等体积的两个密闭容器中分别充满12C18O和14N2两种气体,下列说法正确的是
A.质子数相等,质量不等 B.分子数和质量分别不等
C.分子数和质量都相等 D.原子数、中子数和质子数都相等
[备选]已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含质子的物质的量是
A.  B.
B.

C. (A-n+2)mol D.

[例2](2003全国高考)下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D.PCl5
[备选]已知C3N4晶体很可能具有比金刚石还大的硬度,且原子间均以单键结合。下列有关说法正确的是
A.C3N4晶体是分子晶体
B.C3N4晶体的沸点可能在1000C以下
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键结合
[例3] 右图中直线交点处的圆圈为NaCl晶体中Na+离子和Cl-离子所处的位置。请将其中代表Na+离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na+离子周围与它最接近的且距离相等的Na+离子共有
个。(12个)
右图中直线交点处的圆圈为NaCl晶体中Na+离子和Cl-离子所处的位置。请将其中代表Na+离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na+离子周围与它最接近的且距离相等的Na+离子共有
个。(12个)
[备选]第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需求。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4或1个游离水分子。根据以上信息,完成下面两题
(1)下列关于天然气水合物中两种分子极性的描述正确的是
A.两种都是极性分子 B.两种都是非极性分子
C.CH4是极性分子 D.水是极性分子,CH4是非极性分子
(2)若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离水分子填充,则天然水合物的平均组成可表示为
A.CH4·14H2O B. CH4·8 H2O
C. CH4·23/3H2O D.CH4·8 H2O
[方法归纳]
5.了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com