
题目列表(包括答案和解析)
4.x、y均为短周期元素,且x为ⅠA族元素,y为ⅥA族元素。下列说法正确的是
A.x的原子半径一定大于y的原子半径
B.由x、y形成的共价化合物中所有原子都满足最外层为8电子结构
C.x2y既可能是离子化合物,也可能是共价化合物
D.由x、y组成的化合物中,x、y的原子个数比不可能是1:1
3.关于晶体的下列说法中正确的是
A.只要是离子晶体就一定含有金属阳离子和酸根阴离子
B.原子晶体的熔点肯定高于其他任何一种晶体
C.分子晶体的熔点不一定比金属晶体的熔点低
D.离子晶体中肯定不含有非极性共价键
2. 下列关于只含非金属元素的化合物的说法中,正确的是
A. 有可能是离子化合物 B. 一定是共价化合物
C. 其晶体不可能是原子晶体 D. 其晶体不可能是离子晶体
1.居室装修用石材的放射性常用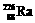 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A.一个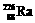 原子中含有138个中子
原子中含有138个中子
B.Ra元素位于元素周期表中第六周期ⅡA族
C.RaCl2的熔点比CaCl2高
D.Ra(OH)2是一种两性氢氧化物
11.(05江苏)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
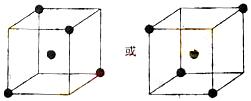
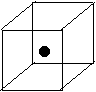 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
 SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
该反应的反应热△H = kJ/mol.
⑴ > < ⑵ 如下图 ⑶ +236
[专题训练B]
10.(2004江苏)1919年,Langmuir提出等电子原理:原子数相同,电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
⑴根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
⑵此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子 、 。
(1)N2 CO; CO2 N2O (2)SO2、 O3
9.(05上海)下列离子中,电子数大于质子数且质子数大于中子数的是
A、D3O+ B、Li+ C、OD¯ D、OH¯
8.(05上海)下列说法错误的是
A、原子晶体中只存在非极性共价键
B、分子晶体的状态变化,只需克服分子间作用力
C、金属晶体通常具有导电、导热和良好的延展性
D、离子晶体在熔化状态下能导电
7.(05广东)下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是
A、NH4Cl?NH3↑+ HCl↑
B、NH3+CO2+H2O=NH4HCO3
C、2NaOH+Cl2=NaCl+NaClO+H2O
D、2Na2O2+2 CO2=2Na2 CO3+O2
6.(05天津)下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;
甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有
共价键的离子型化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com