
题目列表(包括答案和解析)
14.研究短周期元素形成的化合物,可以发现一些共同特点。在A、B、C、D、E五种短周期元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1∶1或2∶1形成化合物,但A、B形成化合物与C、B形成化合物的状态不同。D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4。
(1) 画出D的原子结构简图 ____________________ 。
(2)A与B形成的化合物中,属于极性分子的化合物的化学式为____________。
(3)C与B按原子个数比为1∶1形成化合物的电子式是___________________。
(4)D、E所形成氢化物的稳定性由强到弱的顺序是___________________。
(5)由短周期元素组成的微粒,如,SO2、O3、NO2-,可互称为等电子体,则与B、D同周期元素组成的微粒中,能与N3-、CS2互称为等电子体的微粒是_________。
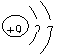
(1)
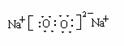
(2) H2O H2O2 (3) (4)HD>EH4 (5)CO2 N2O BeF2
13.下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
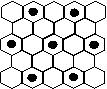
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
(⑴② ⑵PCl3或CCl4 第三周期、ⅥA族 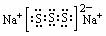 ⑶KC8)
⑶KC8)
12.由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20。下列说法中正确的是
A.晶体中阳离子和阴离子个数不一定相等
B.晶体中一定只有离子键没有共价键
C.所含元素一定不在同一周期也不在第一周期
D.晶体中阳离子半径一定大于阴离子半径
11.X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是
A.② D.②④ C②⑤⑥ D.①②③④
10.X、Y、Z为短周期元素,Y、Z同周期,Y原子中质子数比X原子的大5,Y的族序数比Z小4,而Z的单质分子中含34个电子。有关下列叙述中正确的
A。简单离子半径大小为Z>Y>X
B.熔点:Y、Z形成的化合物大于X、Y形成的化合物
C.X元素可形成两种常见同素异形体
D.X与Y形成的化合物既与盐酸反应又与烧碱溶液反应
9.第三周期元素x,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
A.x元素最高价氧化物对应的水化物一定是强酸
B.x的单质在固态时一定属于原子晶体
C.x元素在常温下稳定存在的氧化物一定能与烧碱反应
D.x的单质一定是良好的半导体材料
8.A和M为两种元素,已知A位于短周期,且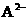 与
与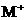 的电子数之差为8,则下列说法中正确的是
的电子数之差为8,则下列说法中正确的是
A.A和M原子的电子数之和可能为11
B.A和M的原子序数之差为8
C.A和M的最外层电子数之和为8
D.A和M原子的最外层电子数之差为
7.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合物的化学式不可能是 A. B.
B. C.
C.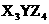 D.
D.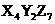
6.2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160 kJ·mol-1,而N≡N的键能为942 kJ·mol-1(键能表示形成化学键释放的能量或者破坏化学键消耗的能量)。则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3
D.用作炸药或高能材料可能是高聚氮潜在的应用
5.短周期元素M的电子层数为x,原子序数为y,已知:y = 2 x3-5x + 3,关于下列说法正确的是
A.最外层有5个电子 B.可以与金属钠形成离子化合物
C.非金属性比氧强 D.其氢化物的沸点比氧的氢化物的高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com