
题目列表(包括答案和解析)
8、(06广东高考) 往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:
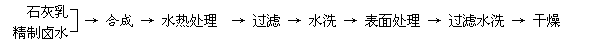
(1) 精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx•mH2O],反应的化学方程式为 。
.... (2) 合成反应后,继续在393K-523K下水热处理8h,发生反应:
[Mg(OH)2-xClx•mH2O]== (1-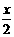 ) Mg(OH)2 +
) Mg(OH)2 +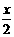 MgCl2 + mH2O
MgCl2 + mH2O
水热处理后,过滤、水洗。水洗的目的是 。
(3) 阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是 。
(4) 已知热化学方程式:Mg(OH)2(s) == MgO(s) + H2O(g);△H1 = +81.5 kJ·mol-1
Al(OH)3(s)
== 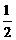 Al2O3(s) +
Al2O3(s) + 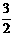 H2O(g);△H 2 = +87.7 kJ·mol-1
H2O(g);△H 2 = +87.7 kJ·mol-1
① Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
② 等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,原因是 。
(5) 常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是
(填代号),理由是 。
7、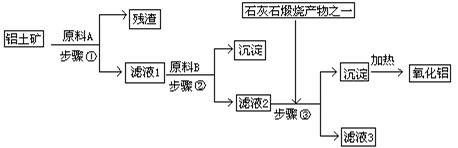 工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
(1) 原料A的名称是_____________,步骤①反应的离子方程式是_________________。
(2) 滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的子方程式是:__________________________________________。
(3) 步骤③的化学方程式是:_____________________________________________。
(4) 如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响___________________________________________________________________。
6、为了预防碘缺乏症,国家规定每千克食盐中应含40-50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如下:
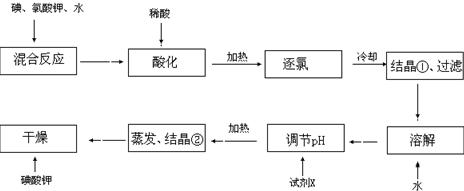
(1) 碘的原子序数为 。
(2) 碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。已知反应时,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
。
(3) 混合反应后,用稀酸酸化的作用是 ,在稀盐酸和稀硝酸中不能选用的酸是 ,理由是
(4) X的化学式为 写出用试剂X调节pH的化学方程式
(5) 生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么影响?
。
4、(07广州综合测试I)重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。
重晶石填料的生产工艺流程为:
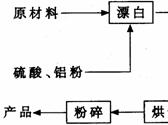
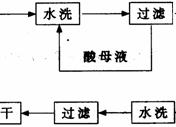
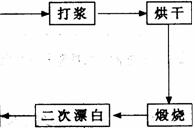
(1) 在该流程中,为加快“漂白”速度,采取的措施有 。
(2) 硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
。
(3) 铝粉也起到了“漂白”的作用。你认为,铝粉是如何起到该作用的?
。
(4) 有同学认为,既然两次水洗,那么铝粉的作用就不大。你的解释是:
。
(5) 煅烧的主要目的是 。
(6) 将煅烧后的固体磨细,使用的是加有刚玉(氧化铝)球的振动磨。这说明刚玉具有很高的 。
3、利用天然气合成氨的工艺流程示意如图。
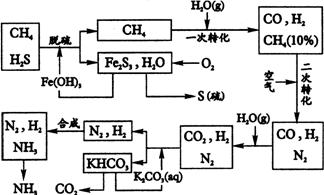
依据所述流程,完成下列填空:
(1) 天然气脱硫时的化学方程式: 。
(2) n molCH4经一次转化后产生CO 0.9n mol产生H2 mol(用含的代数式表示)。
(3) K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是 (多选扣分)
a.相似相容原理 b.勒夏特列原理 c.酸碱中和原理
(4) 由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。
(5) 整个流程有三种循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
2、(06江苏高考)苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。
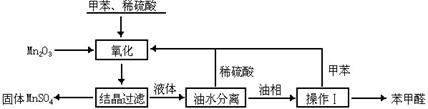
试回答下列问题:
(1) Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是 。
(2) 甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是 。
(3) 实验过程中,可循环使用的物质分别为 、 。
(4) 实验中分离甲苯和苯甲醛采用的操作Ⅰ是 ,其原理是
。
(5) 实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。
|
反应时间/h |
1 |
2 |
3 |
4 |
5 |
|
苯甲醛产率/% |
76.0 |
87.5 |
83.6 |
72.5 |
64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因
。
1、(06上海高考)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
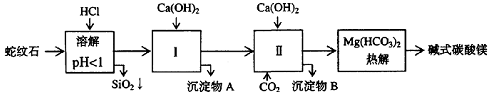
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(2) 进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见右表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致
溶解、 沉淀。
(3) 从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4) 物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_________ (填写物质化学式)。
(5) 现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):①样品称量 ②高温分解 ③
④ ⑤MgO称量
(6) 18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________,b=_________,c=_________。
14.在晶体中具有代表性的最小重复单元,称为晶胞。右图是金属钨晶体中的一个晶胞的结构模型图(原子间实际是相互接触的)。它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量为183.9。假定金属钨为等直径的刚性球,请回答以下各题:
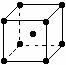 ⑴每一个晶胞中分摊到 个钨原子。
⑴每一个晶胞中分摊到 个钨原子。
⑵计算晶胞的边长a。
⑶计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。
⑷计算金属钨原子采取的体心立方结构的空间利用率。
15. A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是________(选填“A”或“D”);A和B的离子中,半径较小的是________________(填离子符号)。
(2)元素C在元素周期表中的位置是________。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的电子式是________。
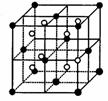
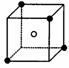
晶胞
晶胞的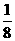
(1)D 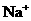 (2)第三周期、ⅢA族
(2)第三周期、ⅢA族
(3)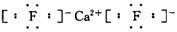 (每空2分,共8分)
(每空2分,共8分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com