
题目列表(包括答案和解析)
1.(1)0.013
(2)0 催化剂
(3)> >
(4)吸热 温度升高时平衡向正反应方向移动
26.(本题每空2分,共14分)
1.(8分)
(1)Na2CO3 (1分) 乙 (1分)
(2)有毒气体不会排放到空气中(2分)
(3)小试管(1分) 大试管倒套有利用于空气排出(1分)Zn +2H+ = Zn2+ + H2↑(2分)
(4)①b ②
③先撤出导管,以免发生倒吸.
14. (1) A CuSO4; G Fe2(SO4)3;(各2分)
(2) 四、Ⅷ;(2分)
(3) 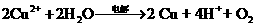
(4)先有白色沉淀生成,然后白色沉淀迅速变成灰绿色再变成红褐色;(2分)
(5) 铁;(2分) Cu2+ + 2e- = Cu(2分)

14.(1)在FeSO4溶液中滴入2滴KSCN溶液,然后再加入浓硝酸,溶液变成血红色。反应的离子方程式为:①____________________________________________,②Fe3++xSCN- [Fe(SCN)x](3-x)+,但过一会,溶液的血红色快速褪去,有红棕色气体放出,(已知Fe2+与HNO3反应是快反应),则产生红棕色气体的原因可能是______离子与HNO3作用的结果。
[Fe(SCN)x](3-x)+,但过一会,溶液的血红色快速褪去,有红棕色气体放出,(已知Fe2+与HNO3反应是快反应),则产生红棕色气体的原因可能是______离子与HNO3作用的结果。
(2)为探究反应原理,取少量浓硝酸于试管中,然后加入KSCN溶液,振荡后滴入BaCl2溶液,设计此实验的目的是______________________________。将产生的气体通入足量的NaOH和Ca(OH)2的混合溶液中,此步骤操作是为了________________________________。
(3)向盛有有[Fe(SCN)x](3-x)+溶液的3支试管中分别滴入①氯水②溴水③碘水,设计此实验的目的是________________________________________________。用KSCN溶液间接检验Fe2+时,氯水、HNO3为什么不能加过量_______________________________。
1 5. “套管实验”具有装置简洁便利等有优点,结合图示回答有关问题。
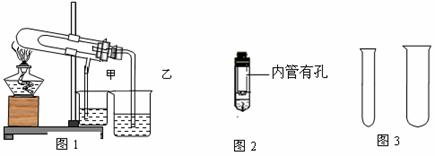
(1)欲利用图1比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物。最好应在大试管
底部加入 (填化学式),石灰水变浑浊的烧杯有______(填:甲、乙)
(2)欲利用图2验证铜与浓硝酸的反应产物,该装置除简洁外,还有一个明显的优点是:
。
(3)用锌粒和稀硫酸用图3制取氢气,并收集一试管,锌粒和稀硫酸应放在 试管中
(填:大、小)组成发生装置,理由是: 。该反应的离子方程式为
13.现有A、B两种有机化合物,已知:
①它们的分子中含有相同数目的碳原子和氧原子,B可以看成A中一个氢原子被氨基取代得到;
②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;
③它们都是一取代苯,分子中都没有甲基,都有一个羧基。
请按要求填空:
⑴A、B的分子中氢元素的质量分数都是___________;
⑵A的结构简式是________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官 能团不直接与苯环相连,C的结构简式是________________________;
⑷B有一同分异构体D是苯环上的一硝基化合物,其苯环和侧链上的一溴代物各有 两种,D的结构简式是__________________________。
12.在一刚性密闭容器中发生化学反应2A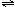 B+D,在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D,在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验 序号 |
时间 浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据以上数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率V(A)为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且c3 1.0mol/L(填>、=、<=。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”或“放热”)。理由是 。
11.如下图所示,A溶液呈蓝色。(图中参加反应的水及生成的水已略去)
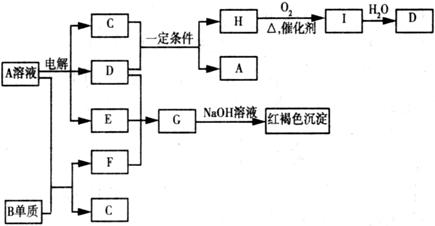
请回答下列问题:
(1)写出A的化学式: ; G的化学式: ;
(2) B元素在元素周期表中的位置为: ;
(3)写出电解A溶液的离子方程式: ;
(4) 若向F的溶液中加入足量的NaOH溶液,可观察到的现象 ;
(5)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的负极材料可以是: ;正极的电极反应是 。
10.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
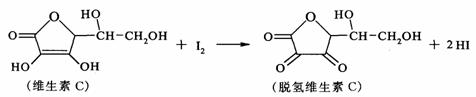
下列说法正确的是 ( )
A.上述反应为取代反应
B.维生素C在酸性条件下水解只得到1种产物
C.维生素C不可溶于水,可溶于有机溶剂
D.维生素C的分子式为C6H8O6
9.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com