
题目列表(包括答案和解析)
2.吸光度与SO2含量 标准曲线的绘制:在6支25ml比色管中,用每毫升含25μg二氧化硫的标准液配置下表标准SO2含量系列。
二氧化硫标准系列
|
管 号 |
0 |
1 |
2 |
3 |
4 |
5 |
|
标准液(ml) |
0 |
0.20 |
0.40 |
0.60 |
0.80 |
1.00 |
|
吸收液(ml) |
10.00 |
9.80 |
9.60 |
9.40 |
9.20 |
9.00 |
|
二氧化硫含量(μg) |
0 |
5.00 |
10.00 |
15.00 |
20.00 |
25.00 |
用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下。
|
管 号 |
0 |
1 |
2 |
3 |
4 |
5 |
|
吸光度 |
0 |
0.20 |
0.40 |
0.60 |
0.80 |
1.00 |
以吸光度值为纵坐标,二氧化硫含量(μg/10mL)为横坐标,绘制标准曲线
1.采样:
①如果你是该兴趣小组成员,你对采样的地点和时间有何建议:
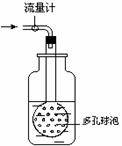
②用右图装置采样,通过50L空气后,将吸收液移入100ml容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用。
用多孔球泡而不用导管的原因是 。
20.2005年江苏酸雨污染有所加重,酸雨发生频率为34.1%,上升了6.2个百分点,每三场雨中就有一场多是酸雨。某校研究性学习小组拟对本市空气中二氧化硫含量(mg·m-3)进行测定。经查阅资料可用以下方法测定:
实验原理:大气中的二氧化硫用甲醛溶液吸收后,生成稳定的羟甲基磺酸加成化合物,再加入氢氧化钠使加成化合物分解,释放出二氧化硫与副玫瑰苯胺、甲醛作用,生成紫红色化合物。据其颜色深浅,用分光光度计在577nm处进行测定。
分光光度计是利用分光光度法对物质进行定量定性分析的仪器。而分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析。其工作原理可以简单的用公式表示为A=KC,其中A为吸光度,K为一定条件下的常数,C为溶液浓度。
 实验步骤:
实验步骤:
18.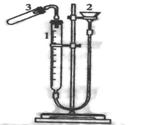 现欲在室温和1.01×105Pa条件下测定金属镁的相对原子质量,请请利用右下图装置进行实验。根据要求回答有关问题:(所需试剂有:镁带、18.4mol·L-1的H2SO4、2.0 mol·L-1的H2SO4。)
现欲在室温和1.01×105Pa条件下测定金属镁的相对原子质量,请请利用右下图装置进行实验。根据要求回答有关问题:(所需试剂有:镁带、18.4mol·L-1的H2SO4、2.0 mol·L-1的H2SO4。)
实验方法如下:
(1)往量气管中注水至刻度“0”或低于“0”的某个位置,
上下移动漏斗。然后将量气管的塞子塞紧。步骤中“上、下
移动漏斗”的目的是
(2)加药品前:应检查该装置的气密性。检验该装置气密性的方法是:
。
(3)气密性经检验完好后,即可加入药品进行实验,且需经4步操作才能测得氢气的体积。请填写所缺操作步骤:
① ;
②移动漏斗使两边液面保持一致,并记下读数为V1;
③将试管竖直,使镁条滑到试管中与酸反应;
④
。
(4)经测定镁与酸反应产生H2的体积为V L(室温、1.01×105Pa),可推算出H2的质量为m(H2),若称取镁带的质量为m(Mg),则镁的相对原子质量的表达式为(相对原子质量用M表示): 。
(5)如果测得的值比实际值偏大,请你分析产生误差偏大的可能原因(假设在测得外界温度、压强以及在换算、计算过程中都没有错误。至少写2条)
① ②
17.下列对实验操作或实验事实的描述正确的是 (填序号)
① 衣服上沾有新的蓝墨水迹可用草酸洗去
②制备绿矾晶体时,反应结束后应将溶液趁热过滤,以减少溶质的损失
③ 测定硫酸铜晶体中结晶水含量的实验中,至少需进行4次称量
④测定中和热时,应将稀NaOH溶液分几次缓缓倒入稀盐酸中,并及时搅拌
⑤ 向某溶液中先滴加新制的氯水,再滴加KSCN溶液可检验Fe2+的存在
⑥ 向蛋白质溶液中加入浓的无机盐(如Na2SO4、CuSO4)溶液,可使蛋白质盐析而分离提纯;
⑦ 在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,用玻璃棒将滤纸捣成糊状,微热并冷却后滴入几滴CuSO4溶液,加热至沸腾,可观察到红色沉淀生成;
⑧ 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
16.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。
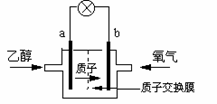
 电池总反应为:C2H5OH +3O2 2CO2 +3H2O,
电池总反应为:C2H5OH +3O2 2CO2 +3H2O,
电池示意如右图,下列说法不正确的是:
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e- = 2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
15.下列离子方程式正确的是
A.等物质的量的Ba(OH)2与明矾加入足量水中
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸 Fe(OH)3+3H+= Fe3++3H2O
C.H218O中投入Na2O2固体 2H218O+ 2O22-=4OH-+ 18O2↑
D.CuCl2溶液中加入NaHS溶液 Cu 2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
14.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通人熔融的硫中制得。下列有关说法正确的是
A S2C12是含有极性键和非极性键的非极性分子
B. 固态时S2C12属于原子晶体
C.S2C12与NaOH的化学方程式可能为:S2C12+6NaOH== 2NaCl+2Na2SO3+3H2O
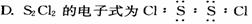
13.咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
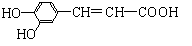 下列有关咖啡酸的说法中,错误的是
下列有关咖啡酸的说法中,错误的是
A.咖啡酸可以发生还原、取代、加聚等反 B.咖啡酸与FeCl3溶液可以发生显色反应
C.1 mol咖啡酸可与4 mol H2发生加成反应 D.1 mol咖啡酸最多能消耗3 mol的NaHCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com