
题目列表(包括答案和解析)
8.将76.8 mg铜与适量的浓硝酸反应,当铜全部溶解后,如果NO3-减少2×10-3 mol,则溶液中H+同时减少
A.4.8×10-3 mol B.4.4×10-3 mol C.3.2×10-3 mol D.2.2×10-3 mol
7. 下列关于晶体的说法一定正确的是:
下列关于晶体的说法一定正确的是:
A.金属晶体的熔点都比离子晶体的熔点低 B. 晶体中一定存在着化学键
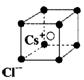
C.氯化铯晶体中每个Cs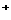 周围与其距离最近的Cs
周围与其距离最近的Cs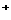 有6个(晶体结构如右图)
有6个(晶体结构如右图)
D.石墨晶体中每个碳原子与4个碳原子以共价键相结合
6.温度为T℃,压强为1.01×106Pa条件下,某密闭容器下列反应达到化学平衡A(g)+ B(g)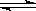 3C(?),测得此时c(A)=0.022
mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是
3C(?),测得此时c(A)=0.022
mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是
A.C为非气态 B.C为气态 C.第二次达到平衡时 C为气态 D.第三次达到平衡时C为非气态
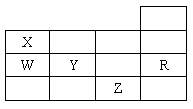
5.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种
元素的叙述中,正确的是
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高 D.Y元素的非金属性比W元素的非金属性强
4.NA为阿伏加德罗常数,下列说法正确的是
 A.28 g乙烷所含有的电子数目为18NA B.常温常压下,1 g氢气所含有的原子数目为NA
A.28 g乙烷所含有的电子数目为18NA B.常温常压下,1 g氢气所含有的原子数目为NA
C.标准状况下,22.4 L单质溴所含有的分子数目为NA
D.电解食盐水若产生71 g氯气,则转移的电子数目为NA
3.根据相关化学原理,下列判断正确的是
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y B.若A2+2D-→2A-+D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
2. A、B、C、D、E均为短周期元素.A、B、C位于同一周期邻位置,它们分别与D形成的化合物分子中都有10个电子,且A和C的原子序数之比为3 :4.E原子从内到外各电子层的电子数之比为1 :4 :1,则下列叙述正确的是 ( )
A.由A和C形成的一种化合物能与E的单质在一定条件下发生置换反应
B.由A、C原子和B、D原子分别构成的分子都是极性分子
C.B、D两种单质相互化合的反应是不可逆反应 D.由A、B、C、D四种元素形成的化合物一定不含离子键
29.(共12分)29.(12分)原创题,根据教材内容,镁在空气中燃烧与O2和CO2反应,其产物是氧化镁。那么对镁与空气中的氮气的反应,比较陌生。本题通过实验探究的形式出现,怎样才能确定氮气与镁发生了化学反应呢?第一根据生成固体的颜色与氧化镁的颜色不同,第二根据容器内水的液面的变化来确定。同时推测氮气与镁反应的产物和产物与水反应的化学方程式。本题注重考查学生根据实验现象和所学知识进行推理的能力,并学会举一反三,触类旁通。
①2Mg+O2 2MgO,2Mg+CO2
2MgO,2Mg+CO2 2MgO+C
2MgO+C
②钟罩中的水面上升大大超过钟罩容积的1/5空气中O2的体积分数约为1/5
CO2的体积分数很小,只有和N2反应钟罩中的水面上升才能大大超过钟罩容积的1/5
③Mg3N2+6H2O==3Mg(OH)2↓+2NH3↑ 3Mg+N2 Mg3N2
Mg3N2
④Al4C3+12H2O==4Al(OH)3↓+3CH4↑
[考后练习]1.C 2.A 3.D 4.B 5 D. 6.C 7.C 8.B9.A 10 D. 11 D. 12.A 13.B
 [考后练习]:1.据世界卫生组织统计,全球约有8000万妇女使用避孕环,常用避孕环都是含金属铜的。据认为,金属铜的避孕机理之一是:铜与子宫分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性,能杀死精子。下列说法或表示正确的是
[考后练习]:1.据世界卫生组织统计,全球约有8000万妇女使用避孕环,常用避孕环都是含金属铜的。据认为,金属铜的避孕机理之一是:铜与子宫分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性,能杀死精子。下列说法或表示正确的是
A.氧化产物是HO2 B.HO2在碱中能稳定存在 C.氧化剂是O2 D.1 mol Cu参加反应有2 mol电子发生转移
28.(15分)
Ⅰ(7分。每空2分)(1) > 9.9×10-7 10-8 (2)c(Cl―)>c(M+)>c(H+)>c(OH―)
Ⅱ(每空2分,共8分).⑴第三周期、ⅠA族
⑵①C+4HNO3(浓) CO2↑+4NO2↑+2H2O ②2Na2O2+2CO2=2Na2CO3+O2 ⑶
CO2↑+4NO2↑+2H2O ②2Na2O2+2CO2=2Na2CO3+O2 ⑶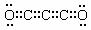
(4) .C(s)+ O2(g)=CO2(g);△H=-393.5 kJ/mol
27.(14分。每空2分). (1) A CuSO4; G Fe2(SO4)3;(各2分) (2) 四、Ⅷ;(2分)
(3) 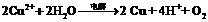 (2分)
(2分)
(4)先有白色沉淀生成,然后白色沉淀迅速变成灰绿色再变成红褐色;(2分)
(5) 铁;(2分) Cu2+ + 2e- = Cu(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com