
题目列表(包括答案和解析)
5.在试管中注入某红色溶液,给试管微热,溶液颜色逐渐变浅,则原溶液可能是
①滴有石蕊的NH4Cl溶液; ②滴有酚酞的饱和氢氧化钙溶液;
③滴有酚酞的Na2CO3溶液; ④溶有SO2的品红溶液
A.② B.④ C.②④ D.②③
4.正确掌握化学用语是学好化学的基础。下列有关表述中正确的一组是
A.C2H4和C4H8两物质中碳的质量分数相同,它们一定是同系物
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.S2-的结构示意图为: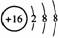 ,乙烯和丁烷的最简式均为CH2
,乙烯和丁烷的最简式均为CH2
D.SiH4、CH4、NH4+的空间构型均为正四面体型;CO2、C2H2均为直线型
3.下列各项比较正确的是
A.稳定性:Na2O > Na2O2 > H2O2 B.粒子半径:Cl- > Na+ > F- > O2-
C.熔点:二氧化硅 > 钠 >镁 >铝> 冰>干冰 D.氧化性:Cl2> Br2 >Fe3+ >I2 >S
2、绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展。而常温离子液体(ionic liquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实。1914年报道的第一种离子液体硝酸乙基铵((C2H5NH3)NO3)离子液体其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.离子液体可以作为电池的电解质
B.硝酸乙基铵水溶液呈碱性
C.硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+
D.相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小
1. 禽流感是禽流行性感冒的简称,它是一种由甲型流感病毒的一种亚型(也称禽流感病毒)引起的传染性疾病,被国际兽疫局定为甲类传染病。10月25日国家禽流感参考实验室确诊,湘潭县射埠镇湾塘村出现了H5N1亚型高致病性禽流感疫情,在疫区村民家里到处都洒满了石灰,甚至是低矮树木的叶子上都洒上了石灰,很是醒目。根据有关化学知识,判断下列说法不正确的是
A.石灰之所以可以杀灭H5N1亚型高致病性禽流感病毒,是由于石灰与水产生的氢氧化钙显碱性,病毒为蛋白质,可以使蛋白质变性,而使病毒失去活性
B.饱和石灰水中加入生石灰,在温度不变的情况下,pH不变
C.饱和石灰水中加入生石灰,在温度不变的情况下,Ca2+的物质的量不变
D.给饱和石灰水溶液升高温度,c(OH-)的浓度降低.
21.(8分)自然界存在的某天然碱(纯净物)的组成
表示 为aNa2CO3·bNaHCO3·cH2O(a、b、c
为正整数)。现称取不同质量的天然碱样品,溶于
水后,分别逐滴加入相同浓度的盐酸30.0mL,产
生二氧化碳的体积(标准状况)如图所示。
(1)若用2.49g样品进行同样的实验时,产生二氧化碳 mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时碳酸钠不分解),产生
112mL二氧化碳(标准状况)和0.450g水,试通过计算确定该天然碱的化学式
。
(3)实验所用盐酸的物质的量浓度为 。
(4)若在上述某次实验中,收集到336mLCO2(标准状况)气体,该次实验中称取天然碱样品的质量可能是 。
20.(10分)科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
 (2)N4H4(SO4)2
(填:“能”或“不能”)和草木灰混合施用;
(2)N4H4(SO4)2
(填:“能”或“不能”)和草木灰混合施用;
(3)已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为
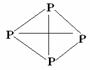
(→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为 ,
请画出N4H44+的结构式 ;
 (4)已知液氨中存在着平衡2NH3 NH4+NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
。
(4)已知液氨中存在着平衡2NH3 NH4+NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
。
(5)含有一定量(NH4)2SO4和NH3·H2O的水溶液称为“缓冲溶液”,以此溶液中加入少量的强碱和强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时:NH3·H2O + H+ = NH4+ +H2O
加碱时:NH4+ +OH- = NH3·H2O
由于(NH4)2SO4和NH3·H2O的大量存在,加少量酸或碱时,溶液中c (H+)与c (OH-)基本保持不变;
含有一定量的NaH2PO4和NaHPO4的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时 ;
加碱时 。
 五、(本题共8分)
五、(本题共8分)
19.(5分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。D、A按原子个数比3:2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是 ,D元素的原子结构示意图是
。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是
(用元素符号填写)。
(3)乙加入到水中发生反应的离子方程式是
18.(13分)某化学小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案
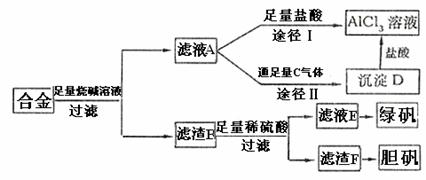 如下:
如下:
试回答下列问题:
(1)过滤用的玻璃仪器有 。
(2)写出滤液A转化为沉淀D的离子方程式 。
(3)由滤液A制AlCl3溶液的途径有Ⅰ和Ⅱ两条,你认为合理的是途径 (填“Ⅰ”和“Ⅱ”),理由是 。
(4)从滤液E中得到绿矾晶体的实验操作是 、 、 。
(5)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式是 。
(6)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理? ;理由是
。
17. (Ⅰ)(7分)德国人哈伯在1905年发明的合成氨反应原理为:N2(g) + 3H2(g) 2NH3(g);已知298K时:△H =-92.4kJ·mol-1,△S =-198.2J·mol-1·K-1,试回答下列问题:
(Ⅰ)(7分)德国人哈伯在1905年发明的合成氨反应原理为:N2(g) + 3H2(g) 2NH3(g);已知298K时:△H =-92.4kJ·mol-1,△S =-198.2J·mol-1·K-1,试回答下列问题:
(1)请根据正反应的焓变和熵变计算分析298K下合成氨反应能自发进行(列出算式即可) 。
其浓度商(Qc) 化学平衡常数(Kc)(填大于、等于、小于)时,反应向右进行。
(2)在实际工业合成氨生产中采取的措施是 (填序号)
A.采用较低压强
B.采用700K左右的高温
C.用铁触媒作催化剂
 D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2
和H2
(3)右图是实验室模拟工业法合成氨的
简易装置,简述检验有氨气生成的
方法 。
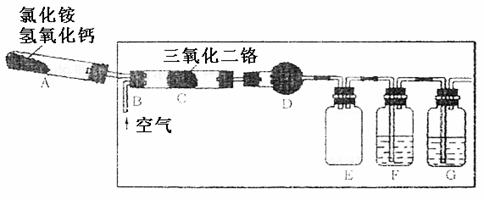 (Ⅱ分)(9分)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学设计了如下装置利用中学实验室常见试剂制取NH3,并以空气、NH3为原料模拟工业制HNO3(三氧化二铬为催化剂,加热及夹持装置未画出):
(Ⅱ分)(9分)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学设计了如下装置利用中学实验室常见试剂制取NH3,并以空气、NH3为原料模拟工业制HNO3(三氧化二铬为催化剂,加热及夹持装置未画出):
回答下列问题:
(1)实验时,A、C两装置均需加热,应先加热 装置,原因是
;
(2)D装置中应填充的物质是 ,该物质的主要作用是
;
(3)E装置的作用是 ,F、G装置中的物质分别是
;
 (4)若保留上图中黑色粗线框中的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中划出装置图并注明所用药品的名称)。
(4)若保留上图中黑色粗线框中的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中划出装置图并注明所用药品的名称)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com