
题目列表(包括答案和解析)
29.(13分)2005年诺贝尔化学奖授予在发现有机物合成转换方面作出杰出贡献的三名科学家:
法国的伊夫·肖万、美国的罗伯特·格拉布和理查德·施罗克。三位科学家获奖原因就是对有机化学烯烃复分解反应的研究作出贡献:他们弄清了如何指挥烯烃分子“交换舞伴”,将分子部件重新组合成别的物质。三人对于有机化学烯烃复分解反应的研究是通往“绿色化学”的重要一步。烯烃的复分解反应也称之为烯烃的歧化反应,反应机理可表示为:
|

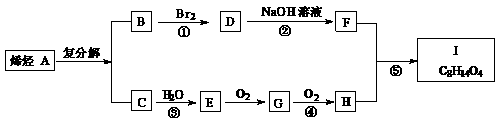
已知同温同压时,C相对于氢气的密度为14,I的分子式为C8H14O4,试根据下图关系,回答问题:
|
(1)已知C的燃烧热为Q kJ/mol,写出C完全燃烧的热化学方程式:
。
(2)反应①、②、③、④、⑤中,属于加成反应的是 。
(3)写出下列化合物的结构简式: A. , I. 。
(4)写出反应②的化学方程式: 。
(5)F有多种属于二元醇的同分异构体,除下列三种外,
|
 ,
,
写出其它同分异构体(一个碳原子上不能连接两个羟基)的结构简式:
。
28.(10分)四川盛产五倍子。以五倍子为原料可制得化合物A。 A的结构简式如右图所示:
(1)A的分子式是 。
(2)有机化合物B在硫酸催化条件下加热发生酯化反应可得到A。
请与出B的结构简式:
(3)请写出A与过量NaOH溶液反应的化学方程式为:
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看成是B与氢气按物质的量之比
1∶2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C与溴水反应的化学方程式为:
27.(16分)A、B、C、D、E是周期表中前20号元素,它们的原子序数依次增大,EA2与水反应产生可燃性气体和白色浆状物,向该浆状物中通入AB2气体可得另一白色不溶物。B、D同主族,
D的阴离子与E的阳离子具有相同的核外电子排布。请回答:
(1)写出元素符号:A 、B 。
(2)已知AD2与AB2的结构相似,AD2的结构式为 ,
该分子是 (填“极性分子”或“非极性分子”)。
(3)镁条在AB2中燃烧的化学方程式为 。
(4)将D单质放入浓HNO3中加热,生成红棕色气体和一种强酸,该反应的离子方程式为
。
(5)A可形成二元弱酸H2A2O4。0.1mol H2A2O4与100mL2mol/L的KOH溶液反应后,溶液中的离子浓度由大到小的排列顺序是 。

26.(11分) A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):请填写下列空白:
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是:
。
(3)E与F反应的化学方程式是:
。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
25.(7分)在密闭容器中,通入amol H2和bmolN2,在一定条件下达到平衡,容器中还剩余cmolN2,
(1)生成NH3的物质的量为 ;
(2)平衡时H2的转化率为 ;
(3)若把容器体积减小一半,则正反应速率变_______;逆反应速率变_______;N2转化率变 。

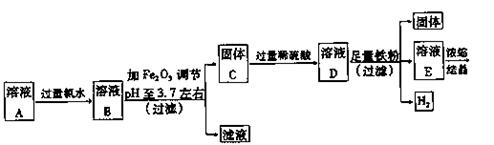
24.(15分)用硫酸处理铁悄所得到的溶液A中除Fe2+外,还含有一定量的Fe3+、Cu2+
|
实验1:制取硫酸亚铁晶体的过程如下图:
|
阳离子 |
开始沉淀的pH |
沉淀完全的pH |
|
Fe3+ |
2.7 |
3.7 |
|
Cu2+ |
5.4 |
6.9 |
|
Fe2+ |
8.1 |
9.6 |
|
Mn2+ |
8.3 |
9.8 |
(1)往溶液A中加过量氯水的作用是 。
(2)右表是使一些金属离子转化为氢氧化物沉淀的pH,根据表中数据分析,固体C是 。
(3)有人提出,在处理溶液B时,先加入几滴石蕊试液,然后逐滴加入NaOH溶液
|
你认为此方案是否可行? (填“行”或“不行”),
其理由是 。
实验2:用下图装置进行测定硫酸亚铁晶体(FeSO4·nH2O)中结晶水含量的实验(图中半透膜可让气体通过又可防止固体粉末进入导管):将m1g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水,冷却至常温后,称量玻璃管中固体的质量为m2g。
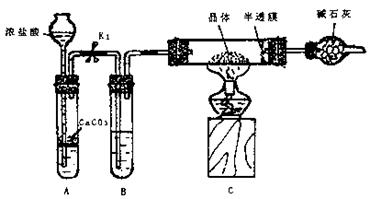
(1)B中的试剂是 。
(2)实验中有以下步骤:
①打开K1 ②关闭K1 ③点燃酒精灯 ④熄灭酒精灯火焰,使C中玻璃管冷却至常温。
正确的实验操作顺序是 (填以上选项序号)。
(3)根据实验结果,计算硫酸亚铁晶体中结晶水的n值为 。
(摩尔质量:FeSO4为152g·mol-1;H2O为18g·mol-1)
23.(4分)下列操作会使实验测得结果偏大的是(填选项的序号,下同) ;
对实验结果不产生影响的是 。
①用湿润的pH试纸测定某NaHCO3溶液的pH
②中和滴定实验中用洗净的锥形瓶装待测液
③用潮湿坩埚作硫酸铜晶体结晶水含量测定的实验。
④用潮湿的小烧杯作中和热测定的实验
22.一定量的铁和三氧化二铁的混合物投入250 mL 2mol/L的足量硝酸溶液中,反应完成后,生成1.12L NO(标况下)。再向反应后的溶液中加入1 mol/L氢氧化钠溶液,要使铁元素完全沉淀,加入氢氧化钠溶液的体积最少是[ ]
A.400mL B.450mL C.500mL D.不能确定

 惠南中学2007届高三第一学期期末考试
惠南中学2007届高三第一学期期末考试
化学试卷
第Ⅱ卷(非选择题 共84分)
21.某有机物A的化学式为C6H12O2,已知A-E有如图转化关系,且D不与Na2CO3溶液反应,
C、E均能发生银镜反应,则A的结构可能有[ ]

A.3种 B.4种 C.7种 D.8种
20.香兰素的结构简式如下图所示,它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料。下列关于香兰素的判断不正确的是[ ]
 A.和浓硫酸混混合加热,可发生消去反应
A.和浓硫酸混混合加热,可发生消去反应
B.可与银氨溶液反应
C.可与浓溴水发生取代反应
D.可与氢氧化钠溶液反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com