
题目列表(包括答案和解析)
2.2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,己知硫化羰的结构与二氧化碳相似,但能在氧气中完全燃烧,下列有关硫化羰的说法中正确的是
A.硫化羰是酸性氧化物 B.硫化羰是由极性键构成的非极性分子
C.硫化羰可用做灭火剂 D.硫化羰在氧气中完全燃烧后的生成物是CO2和SO2
27.(10分)根据烷烃、烯烃、炔烃燃烧的反应式,有人总结出如下规律:
对于烷烃有:n(烷烃)= n(H2O)- n(CO2);对于烯烃: n(H2O)- n(CO2)= 0;对于炔烃有:n(炔烃)= n(CO2)- n(H2O)。请回答下列问题:
(1)C2H6和C2H4混合气1.0L在氧气中充分燃烧生成2.0LCO2和2.4L水蒸气(相同状况),则混合气中C2H6和C2H4的体积是 (填序号)。
(A)3:1 (B)1:3 (C)2:3 (D)3:2
(2)某混合气体由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0体积混合气在氧气中充分燃烧,产生3.0体积水蒸气和3.7体积CO2(相同状况下测定)。
①判断混合气由 和 两类烃组成。
②上述判断的理由是 (简要文字)。
③上述两类烃的体积比为 。
|
|
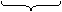
|
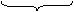
 例如:2CH3COOK + 2H2O CH3CH3
+ 2CO2↑ + H2↑ + 2KOH
例如:2CH3COOK + 2H2O CH3CH3
+ 2CO2↑ + H2↑ + 2KOH
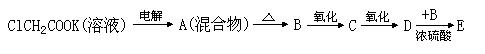 根据下列演变关系:
根据下列演变关系:
(1)写出电极反应式
阳极 ;阴极 。
(2)写出下列反应的化学方程式:

 A
B
; B C 。
A
B
; B C 。
(3)D和B在不同条件下反应,会生成3种不同的E,其中属于高分子的E为
。
26.(9分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
(1)碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
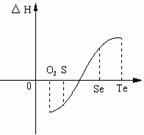 (2)等物质的量氧气、硫、硒、碲与H2反应的焓变
(2)等物质的量氧气、硫、硒、碲与H2反应的焓变
情况如图所示:
请回答下列问题:
(1)H2与硫化合的反应 热量(填“放
出”或“吸收”)。
(2)已知H2Te分解反应为熵增反应,请解释为什么Te和H2的反应不能自发发生 。
(3)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为α甲、α乙,甲容器中平衡常数表达式为
(用含α甲的代数式表示),此时α甲 α乙(填“大于”、“小于”或“等于”)。
25.(9分)“卤块”的主要成分为MgCl2(含Fe3+、Fe2+、Mn2+等杂质离子),若以它为原料,按如下的工艺流程图,即可制得“轻质氧化镁”。
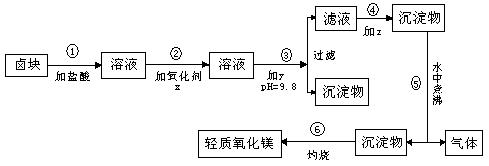
生成氢氧化物沉淀的pH 化学试剂价格表
|
物质 |
开始沉淀 |
沉淀完全 |
|
试剂 |
价格/元/吨 |
|
Fe(OH)3 |
2.7 |
3.7 |
漂液(含NaClO25.2%) |
450 |
|
|
Mn(OH)2 |
6.3 |
9.8 |
H2O2(30%) |
2400 |
|
|
Mg(OH)2 |
9.6 |
11.1 |
NaOH(固体,98%) |
2100 |
|
|
|
|
|
Na2CO3(固体99.5%) |
600 |
|
|
|
|
|
卤块(MgCl2,30%) |
310 |
如果要求产品尽量不含杂质,而且成本较低。请回答问题:
(1)在步骤②加入的氧化剂x,最佳选择应是 ,其作用是 。
(2)在步骤③加入的试剂y应是 ,之所以要控制pH=9.8,其目的
是 。
24. (9分)科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
⑴ N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
⑵ N4H4(SO4)2______ (填“能”或“不能”)和草木灰混合施用;
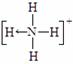 ⑶ 已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为
⑶ 已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为
(→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式
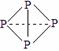
为 ,请画出N4H44+的结构式 。
⑷ 已知液氨中存在着平衡2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
23.(15分)某工业产品硫酸铁中含有少量的FeSO4杂质。现要测定其中铁元素质量分数,设计了如下实验步骤:
①称量ag样品,置于烧杯中;
②加入适量稀硫酸和适量蒸馏水,使样品溶解,然后配成250mL溶液;
③准确量取25.00mL操作②中配得的溶液,置于烧杯中,加入适量的溴水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到蒸发皿内。加热、搅拌,直到固体全部由红褐色变为红棕色后,冷却至室温后,称量;
⑦······
根据以上实验设计,回答:
(1)溶解样品时加入稀硫酸的目的是 ;
(2)加入溴水后,发生反应的离子方程式是 ;
(3)加入氨水要过量的原因是 ;
(4)洗涤的目的是洗去附着在沉淀上的 ,在过滤器上洗涤沉淀的操作是 。
(5)第⑥步操作中,将沉淀物加热,冷却至室温,称量其质量为bg,再加热并冷却至室温称量其质量为cg,且b – c = 0.3,接下来的操作应当是 ;
(6)若蒸发皿的质量为w1,蒸发皿与加热后固体总质量是w2,则样品中铁元素的质量分数是 。(列出算式,不需化简)
21. (6分)下列有关实验的叙述,正确的是(填序号)(少一个扣一分,多一个倒扣一分,扣完为止) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
|
实验室制取Cl2的原理是:MnO2 + 4HCl(浓) === MnCl2 + 2H2O + Cl2↑
(1)从下图中挑选所需仪器,画出收集纯净干燥Cl2的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。
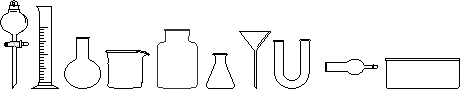
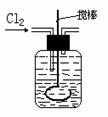 (2)将氯气通入盛有两种互不相溶的中性液体的容器中,如下图所示。当Cl2通入后,上层液体呈现棕色,且颜色由浅变深,然后用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(2)将氯气通入盛有两种互不相溶的中性液体的容器中,如下图所示。当Cl2通入后,上层液体呈现棕色,且颜色由浅变深,然后用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
① 上层液体通入Cl2后发生的
离子反应方程式是_____ ___。
②原上层液体是________________。
③原下层液体是________________。
④上下剧烈搅动的目的是____________________________。
⑤要检验上层液体中含有的金属离子,其方法是________,现象是_______。
⑥实验结束后,若要将两种液体分离,要用到的玻璃仪器是_______。
20. 已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B. c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C. c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D. c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
第Ⅱ卷(非选择题,共80分)
19.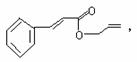 对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1-丙烯酯:
对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1-丙烯酯:
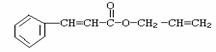
 可简化为
可简化为
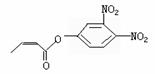
杀虫剂“阿乐丹”的结构表示为 ,若它在稀酸作用下
能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.遇FeCl3溶液均显紫色 B.均能发生银镜反应
C.均能与溴水发生反应 D.均能与NaOH溶液发生反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com