
题目列表(包括答案和解析)
22.(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,Cu2+与I-作用可生成I2,I2溶于过量的KI溶液中:I2+I-=I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用c mol/LNa2S2O3标准溶液滴定,其反应为:
2S2O32-+I3-=S4O62-+3I-。
操作:准确称取ag胆矾试样(可能含少量Fe2(SO4)3),置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol/LH2SO4溶液、少量NaF,再加入足量的10% KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入指示剂,用Na2S2O3标准溶液滴定至终点,共用去V mL标准溶液。回答下列问题:
⑴实验中,加KI前需加入少量NaF,其作用可能是
;
加3mol/LH2SO4溶液的作用可能是 。
⑵滴定实验中所用指示剂是 ;滴定终点的判断方法为
。
⑶本实验中用碘量瓶而不用普通锥形瓶是因为:
。
⑷硫酸铜与碘化钾反应后被还原白色的碘化亚铜沉淀,该反应的离子方程式为:
。
⑸根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= 。
21.(10分)实验室中的氢氧化钠固体常因保管不善而使其中混有少量的碳酸钠杂质。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,某同学设计了如下实验方案:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(1)请列举三种实验过程中会用到的玻璃仪器:___________、___________、___________。
(2)洗涤过滤器上沉淀的操作要点是
。
(3)混合物中碳酸钠的质量分数为(用m、n表示) 。
(4)Ca2+、Ba2+都可以使CO32-沉淀完全,但某同学使用氯化钡溶液而不用氯化钙溶液的原因
是 ;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,
原因是
。
20.现有下列四个图像:
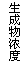
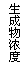
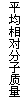
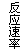
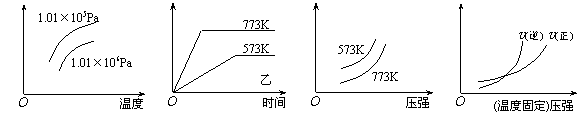
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g)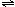 2NH3(g);△H=-Q1 kJ/mol(Q1>0)
2NH3(g);△H=-Q1 kJ/mol(Q1>0)
B.2SO3(g)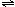 2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
C.4NH3(g)+5O2(g)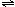 4NO+6H2O(g);△H=-Q3 kJ/mol(Q3>0)
4NO+6H2O(g);△H=-Q3 kJ/mol(Q3>0)
D.H2(g)+
CO(g)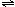 C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0)
C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0)
19.下列根据实验现象所作出的结论中一定正确的是
A.无色试液使红色石蕊试纸变蓝,结论:该试液一定是碱溶液
B.无色试液加入银氨溶液,加热出现银镜,结论:试液中含有醛
C.无色试液焰色反应呈黄色,结论:试液中一定含有Na+
D.无色试液加入碳酸钠溶液产生白色沉淀,结论:试液中含氢氧化钙
18.用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是
A.阳极上析出5.6 mL O2(标准状况) B.阴极上析出32 mg Cu
C.阴极上析出11.2 mL H2(标准状况) D.阳极和阴极质量都无变化
17.以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)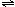 SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.该滴定反应可以表示为:SO32- + SO2+=2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
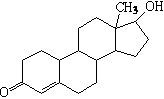
16.诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,
其结构简式如右图所示。下列关于诺龙性质的说法中不正确的是
A.能与氢气反应 B.能与金属钠反应
C.能与NaOH溶液反应 D.能与新制Cu(OH)2悬浊液反应
15.下列离子方程式中书写正确的是
A.NaClO溶液中加入氢碘酸溶液:ClO- + 2H+ + 2I- = I2 + Cl- + H2O
B.过量铁与稀HNO3反应:3Fe +4H+ + 2NO3- = 3Fe2+ + 2NO↑+ 2H2O
C.AlO2-的水解:AlO2- +2H2O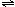 Al(OH)3
+ OH-
Al(OH)3
+ OH-
 D.HS-的水解:HS- + H2O
D.HS-的水解:HS- + H2O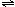 H3O+
+ S2-
H3O+
+ S2-
14.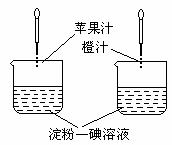 利用维生素C能使淀粉-碘溶液褪色的性质,通过实验(如图所示)比较加入苹果汁和橙汁的多少来确定它们中维生素C含量的多少。要得出正确结论,在实验时需要控制的条件是
利用维生素C能使淀粉-碘溶液褪色的性质,通过实验(如图所示)比较加入苹果汁和橙汁的多少来确定它们中维生素C含量的多少。要得出正确结论,在实验时需要控制的条件是
A.实验时必须向两烧杯中同时滴加液体
B.淀粉-碘溶液的体积和浓度必须相等
C.胶头滴管滴出的果汁的滴数必须相等
D.胶头滴管滴出的每滴果汁的体积必须相等
13.右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是
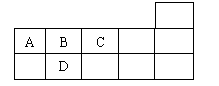 A.原子半径大小比较为A>B>C>D
A.原子半径大小比较为A>B>C>D
B.生成的氢化物稳定性为A>B>C>D
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下均不导电
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com