
题目列表(包括答案和解析)
13、能正确表示下列反应的离子方程式的是( )
A、碳酸氢铵溶液中加入NaOH溶液共热:NH4++OH- NH3 ↑+H2O
B、用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O ==2HCO3-+SO32-
C、FeBr2溶液中加入过量的氯水:2Fe2++2Br-+2Cl2 ==Br2+4Cl-+2Fe3+
 D、碳酸氢钙溶液中加入过量氢氧化钙溶液:Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+
CO32-
D、碳酸氢钙溶液中加入过量氢氧化钙溶液:Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+
CO32-
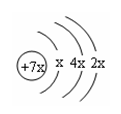
12、a、b、c、d是四种短周期元素。a、b、c 同周期,c、d是同主族。a 的原子结构示意图如右,b与c形成离子化合物b3c。下列比较中,正确的是( )
A、原子序数:a>b>c B、原子半径:c>a>d
C、单质的活泼性:c>a>d D、最高价含氧酸的酸性:d>c>a
11、下列说法正确的是( )
A、钢铁在海水中比在河水中更易腐蚀,主要原因是海水中含氧量高于河水
B、相同温度下,1 mol/L氨水溶液与0.5 mol/L氨水溶液中,c(OH-)之比是2:1
 C、相同温度下等体积等物质的量的Na2S、Na2SO4、NaHSO3、H2SO3四种稀溶液所含带电粒子数由多到少
C、相同温度下等体积等物质的量的Na2S、Na2SO4、NaHSO3、H2SO3四种稀溶液所含带电粒子数由多到少
D、H2S、HCl、PH3的热稳定性由弱到强
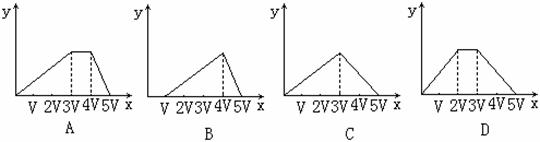
10、向物质的量相等的硫酸铝和硫酸铵溶于水形成VmL混合溶液中,逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
9、在密闭容器中,反应SO2(g)+NO2(g) NO(g)+ SO3(g)
达到平衡后,往容器中通入少量的O2,此时将会发生的变化是( )
NO(g)+ SO3(g)
达到平衡后,往容器中通入少量的O2,此时将会发生的变化是( )
A、容器内压强增大,平衡向逆反应方向移动
B、容器内压强不变,平衡向正反应方向移动
C、容器内压强增大,平衡不移动
D、容器内压强不变,平衡向逆反应方向移动
8、常温下,分别在pH = 1的酸和pH = 14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )
A、酸是多元强酸,酸、碱溶液体积相同 B、酸是一元弱酸,酸、碱溶液体积相同
C、酸是硝酸,其体积比碱溶液大 D、酸是强酸,其浓度比碱溶液大
7、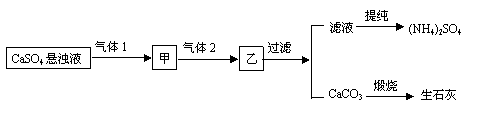 某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
下列推断中,不合理的是( )
A、气体1是CO2,气体2是NH3 B、通入的NH3必须过量
C、CO2可被循环使用 D、生成1mol(NH4)2SO4至少消耗2 mol NH3
6、下列各组离子在溶液中能大量共存的是( )
A、Ca2+、HCO3-、Cl-、K+ B、Al3+、AlO2-、HCO3-、Na+
C、Fe2+、NH4+、SO42-、S2- D、Fe3+、SCN-、Na+、CO32-
5、阿伏加德罗常数约为6.02╳1023 mol-1,下列叙述正确的是( )
A、常温常压下,18.0g 重水(D2O)所含的电子数约为10×6.02×1023
B、11.2L O3所含的原子数约为1.5×6.02×1023
C、标准状况下,22.4L Cl2和HCl的混合气体中含分子总数约是为 2×6.02×1023
D、0.1 mol Br原子中含中子数约为4.6×6.02×1023
4、将饱和FeCl3溶液滴入沸水中可得红褐色液体,该液体不具有的性质是( )
A、光通过该液体时形成光亮的“通路”
B、插入电极通直流电后,有一极附近液体颜色加深
C、向该液体中加入硝酸银溶液,无沉淀产生
D、将该液体加热、蒸干、灼烧后,有Fe2O3生成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com