
题目列表(包括答案和解析)
5.下列关于化学实验及应用的叙述正确的是
①配制500mL 0.1mol·L-1的NaCl溶液选用两只250mL的容量瓶
②向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
③吉林石化厂泄漏到松花江水域的苯、硝基苯可用活性炭吸附
④将干燥的pH试纸浸入某溶液一会儿后取出,与标准比色卡比较以测定该溶液的pH
⑤向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
A.①② B.②③ C.①②③⑤ D.②③④⑤
4.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3+N2+3C 2AlN+3CO。下列叙述正确的是
2AlN+3CO。下列叙述正确的是
A.氮化铝晶体属于分子晶体
B.氮化铝中氮元素的化合价为-3
C.上述反应中生成2mol AlN时,N2得到3mol电子
D.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
3.下列叙述正确的是
A.12C与13C互为同素异形体
B.高级脂肪酸的甘油酯不是高分子化合物
C.Cl2属于非电解质
D.常温下Fe、Al与浓H2SO4不反应
2.下列化学用语正确的是
A.碳-12原子 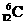 B.羟基的电子式 ∶
B.羟基的电子式 ∶ ∶H
∶H
C.硫离子的结构示意图 D.乙烯的结构简式CH2CH2
D.乙烯的结构简式CH2CH2
1.2008夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念,其中“绿色奥运”是指
A.把环境保护作为奥运设施规划和建设的首要条件
B.严禁使用兴奋剂,使运动员公平竞争
C.所有奥运用品和食品全都是绿色的
D.奥运场馆建设均使用天然材料,不使用合成材料
28、在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:

(1)碘位于元素周期表中的第 周期,第 族。
(2)步骤①加Fe的目的是 。
(3)写出步骤②的化学方程式 。
(4)上述生产流程中,可以利用的副产物是 ,考虑原料循环利用,若将该副产物制成生产所需的试剂,先后还需加入 来进行处理。
(5)甲物质见光易变黑,其原因是(用化学方程式表示): 。
(6)第⑤步操作可供提纯I2的两种方法是 和 。
27、(10分)、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
 ② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是
。
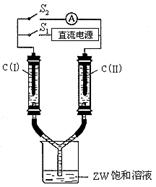
(3)如右图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(I)、C(II)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时C(I)的电极名称是 (填写正极或负极); C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
26、(11分)
25℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。
(1)若所得溶液的pH=11,且a=13,b=2,则Va︰Vb= 。
(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4(填“可”或“否”)
,其理由是 。
(3) 为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为
AG=lg。25℃时,若溶液呈中性,则AG= ,溶液的pH与AG的换算公式为AG= (要简化)。
25、(8分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 ,
K值大小与温度的关系是:温度升高,K值 。
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g) + H2O(g)  CO2(g) + H2 (g) △H1 <0
CO2(g) + H2 (g) △H1 <0
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)= mol/(L•min)

(3) t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于 状态;
C1数值 0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min-6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
24、(8分)2005年我国成功发射了“神州六号”载人飞船,标志着我国航天技术走在了世界前列。
(1)肼(N2H4)是发射航天飞船常用的高能燃料。将NH3和NaClO按一定物质的量比混合反应,生成肼、NaCl和水,写出该反应的化学方程式: ;该反应的还原产物是 。
(2)在火箭推进器中装有强还原剂肼和强还原剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热。已知12.8g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;1mol液态水变成1mol水蒸气需要吸收44kJ的热量。写出液态肼与过氧化氢反应生成液态水的热化学方程式: 。
(3)新型无机非金属材料在航天事业上有广泛应用。氮化硅陶瓷是一种重要的结构材料。氮化硅(Si3N4)晶体是一种超硬物质,耐磨损、耐高温。氮化硅晶体类型是 ;晶体中存在的化学键是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com