
题目列表(包括答案和解析)
6.(06年泰安市高三全程整理性检测题,25)(7分)在化工分析中常用到滴定度这个概念。滴定度是指每毫升滴定剂标准溶液相当于被测组分的质量,其单位为g/mL。现有一不溶于水的氧化亚铜样品,该样品能溶于用硫酸酸化了的硫酸铁溶液,所发生反应的化学方程式为(未配平):
Cu2O+Fe2(SO4)3+H2SO4→CuSO4+FeSO4+H2O。反应生成的硫酸亚铁用硫酸酸化了的高锰酸钾溶液进行滴定,其滴定反应的化学方程式为(未配平):
KMnO4+H2SO4+FeSO4→Fe2(SO4)3+MnSO4+K2SO4+H2O。
若每升滴定剂溶液中含有0.400molKMnO4,求该KMnO4溶液对Cu2O的滴定度。
5.(06年深圳市高三第一次调研,22)(10分)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米顺粒(杂质),这种颗粒可用氧化气化法提纯,其反应式为:
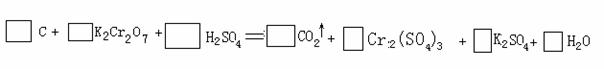 ⑴完成配平上述反应的化学方程式;
⑴完成配平上述反应的化学方程式;
⑵此反应的氧化剂是 ,氧化产物的电子式 ;
⑶H2SO4在上述反应中表现出来的性质是 (填选项编号)(多选倒扣分);
A酸性 B氧化性 C吸水性 D脱水性
⑷上述反应中若产生0.2molCO2气体,则转移电子的物质的量是 mol。
4.(06年湖州市期考,19)(8分)某一反应体系有反应物和生成物共五种物质:O2 、
H2CrO4 、Cr(OH)3 、H2O 、H2O2 已知该反应中H2O2只发生如下过程:H2O2→O2
⑴ 该反应中的还原剂是___________________。
⑵ 该反应中,发生还原反应的过程是____________ → ________________。
⑶ 写出该反应的化学方程式,并标出电子转移的方向和数目
_______________________________________________________。
⑷ 如反应转移了0.3mol电子,则产生的气体在标准状况下体积为_______________。
3.(06年揭阳市统考,27)(10分)为测定一置于空气中的某用硫酸酸化的FeSO4溶液
中的Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+ 和Fe3+的水解)的FeSO4
溶液200mL,加入过量的BaCl2溶液,充分反应后过滤,洗涤干燥,得到沉淀28.0g,再
另取同样的FeSO4溶液200mL,向其中加入过量的NaOH溶液,搅拌使其充分反应,待
沉淀全部变为红褐色后过滤、洗涤并灼烧所得固体,最终得到固体8.0g,
(1)通过计算,填写下表
(2)计算溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+ 、Fe3+)与c(H+)、c(SO42-)的关系。
2.(06年北京西城区期考,21)(6分)神舟6号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼[(CH3)2N-NH2],氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是 ,产生该气体的化学反应方程式为 。
(2)偏二甲肼在N2O4中燃烧的化学方程式为 ,
当有1mol偏二甲肼燃烧时,转移电子的物质的量为 。
1.(06年宿迁市部分重点中学联合调研,21)(10分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并
放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。写出其中涉及到的化学方程式: ;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式 ;
②反应中生成的氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
45.(06年扬州市第二次调研,18)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、
NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为4﹕1﹕4时,实际参加
反应的FeS与HNO3的物质的量之比为
A.1∶6 B.2∶15 C.2∶3 D.16∶25
44.(2006年扬州市期末调研,15)从矿物学资料查得,一定条件下自然界存在如下反应: ,下列说法正确的是
,下列说法正确的是
A. FeS2只作还原剂,CuSO4只作氧化剂
B. 5mol FeS2发生反应,有7mol电子转移
C.产物中的SO42-离子都是氧化产物
D. Cu2S既是氧化产物又是还原产物
43.(06年徐州市第一次质量检测,3).据最新报道,科学家发现了如下反应:
O2 + PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列
说法正确的是
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1 mol O2(PtF6) 则转移1 mol电子
D.在O2(PtF6)中不存在共价键
42.(06年宿迁市第四次模拟考试,11)研究发现CuSO4和FeS2在一定条件下可发生如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4 下列说法正确的是
|
A.FeS2中的硫元素全部被氧化 |
|
B.5molFeS2发生反应,有10mol电子转移 |
|
C.产物中SO42-离子有一部分是氧化产物 |
|
D.FeS2只作还原剂 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com