
题目列表(包括答案和解析)
3.CO2通入CaCl2溶液中是否有沉淀的分析错误。
可用反证法:如能产生沉淀,则反应的化学方程式为:CO2+CaCl2+H2O=CaCO3↓+2HCl。因CaCO3溶于盐酸,故反应不能发生。因为CO2只有通入中性或碱性溶液才能产生CO32-,并同时产生部分H+,若原溶液无法消耗这部分H+,则不利于CO2转化为CO32-,也就无法与Ca2+形成沉淀。若要使CaCl2与CO2反应生成沉淀,就必须加入部分碱溶液中和CO2与H2O反应而产生的H+。同理,该思维方式适用于CO2、SO2通入CaCl2或BaCl2溶液。
0.0001mol 0.0001mol 现盐酸不足,故无气体产生。
答案:D
2.Na2CO3溶液中滴加盐酸过程不清楚。
在Na2CO3溶液中滴加HCl,CO32-先转化为HCO3-,再滴加盐酸HCO3-转化为H2CO3,不稳定分解为CO2。
如:在10mL0.01mol/L纯碱溶液中,不断搅拌并逐滴加入1.2mL0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为(1998年上海高考题)
A.1.334mL B.2.240mL C.0.672mL D.0mL
思路分析:反应过程为:CO32-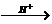 HCO3-
HCO3-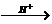 CO2。
CO2。
盐酸溶液中n(HCl)=0.00006mol,纯碱溶液中n(Na2CO3)=0.0001mol
CO32- + H+ = HCO3-
1.CO2通入NaOH溶液的判别错误。
CO2通入NaOH溶液的反应与CO2气体通入量有关。当CO2通入少量时生成Na2CO3,当CO2通入过量时生成NaHCO3,CO2通入量介于两者之间,既有Na2CO3又有NaHCO3。因此推断产物时一定要注意CO2与NaOH间量的关系。
25.将下列离子:Al3+、Na+、K+、NO3-、OH-、S2-、MnO4-、H+、Fe3+、NH4+、AlO2-、CO32-分成A、B两组,每组中都含有六种离子(不少于两种阳离子和两种阴离子),且都能大量共存于溶液中,则A组含有的离子是 ,B组含有的离子是 。
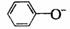
24.下列各组离子中能在水溶液中大量共存,且溶液显酸性的是( )
A.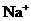 、
、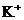 、
、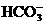 、
、 B.
B.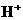 、
、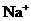 、
、 、
、
C.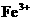 、
、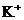 、
、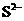 、
、 D.
D.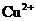 、
、 、
、 、
、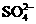
23.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍为无色,则下列关于该溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含SO32- ④可能含I-
A.①② B.①②③ C.①③ D.②③④
22.某溶液中含有CH3COO-、SO42-、SO32-、HCO3-、CO32-等五种离子。将过量的Na2O2固体加入其中后,仍能大量存在的离子是
A.CH3COO-、SO42-、HCO3- B.SO42-、SO32-、CO32-
C.SO32-、HCO3-、SO42- D.CH3COO-、SO42-、CO32-
21.下列各组离子能大量共存于同一溶液中,且加入少量NaOH溶液或适量稀H2SO4时,都能产生沉淀的是
A.Ba2+、Mg2+、NO3-、CO32- B.Na+、Al3+、Cl-、AlO2-
C.Ca2+、K+、Cl-、HCO3- D.NH4+、Fe3+、Ba2+、Cl-
20.向某溶液里加入过量的氨水或过量的氢氧化钠溶液,均有沉淀产生;若加入铁粉或铜粉,溶液的质量都增加,则该溶液里一定含有下列离子中的
A.Al3+ B.Fe2+ C.Fe3+ D.Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com