
题目列表(包括答案和解析)
4.(8分)(盐城市07二模)江苏省东部沿海有954 km的海岸线,合理开发和利用海洋资源对江苏经济发展意义重大。下图是部分元素的单质及其化合物的转化关系图(有关反应条件及部分反应物
或生成物已略去)。已知:A是海水中的重要资源;C、D、F是单质,其中C、D在常温常压下是气体;反应②是化工生产中的重要反应,生成物E是84消毒液的有效成份;J、K均为不溶于水的物质,其中J为红褐色。
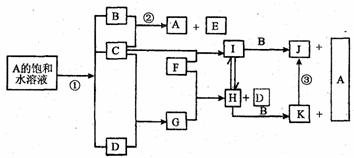
请按要求填空:
(1)反应①的离子方程式(请注明反应条件) 。
(2)B的电子式____;E的化学式____。
(3)③的化学方程式 。
(4)D被誉为很有发展前途的未来燃料。你所了解的实现该目标尚存在的实际问题有
(列举一条)。
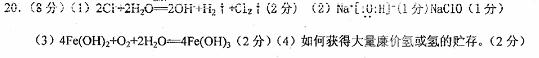
3.(12分)
(1)ab(2分);(2)d(1分);(3)MnO2;KOH(2分);(4)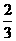 (1分);
(1分);
(5)cd(2分);A(1分);
(6)过滤(1分);溶解度(1分);浓缩结晶(只填“结晶”不给分)(1分)
3.(2007年上海调研卷)
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
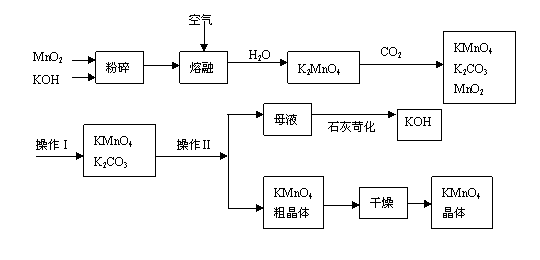

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是_____________(选填代号)。
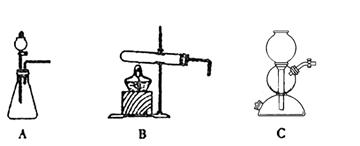
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
2、(10分)(1)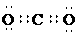 (2分)
(2分)
(2)K3Fe(C2O4)3 (2分)
(3)3CO+Fe2O3===2Fe+3CO2(2分)
(4)2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(5)因为溶液中的草酸根被高锰酸钾氧化,溶液中的Fe3+与SCN-离子反应。(2分)
2.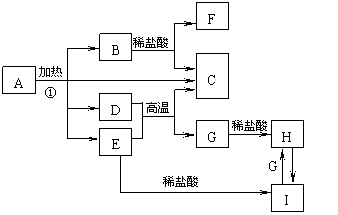 (扬州07一模)(10分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A-H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
(扬州07一模)(10分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A-H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
已知:A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且式量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色。
回答下列问题:
(1)C的电子式 。
(2)A的化学式 。
(3)D+E→C+G的方程式 。
(4)H+H2O2→I的离子反应方程式 。
(5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是 。
1.⑴沸腾炉
⑵G
⑶Mg+2NH4+=Mg2++H2↑+2NH3↑ Fe3++3H2O(沸)=Fe(OH)3(胶体)+3H+
⑷SOCl2 (每空2分,共10分)
1.(10分)(2007南通一模)已知:A为常见金属,B是一种盐,C中A元素的质量分数为25.3%,K是一种重要的矿石,D、E、G、H常温下均为气体,L是红褐色固体。②、③、⑤均为工业生产中的重要反应。各物质间的相互转化关系如下图:(其中某些反应的部分生成物被略去)
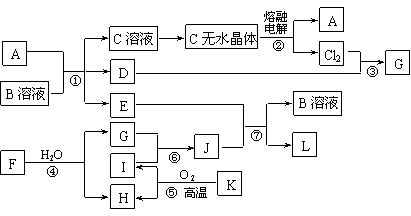
请按要求填空:
⑴工业生产中,实现反应⑤的设备是 。
⑵由“C溶液→C的无水晶体”需特定的气体氛围,该气体是上述转化关系中的 (填“字母”)。
⑶反应①的离子方程式为 ;
将J滴入沸水中的离子方程式为 。
⑷若反应④表示为“F+H2O=2G+H”,则可推知F的化学式___ __。
21(10分)、现有废液,其中含有CuCl2、FeCl2、HCl。某课外活动小组计划用它得到纯净的FeCl2晶体。为此设计如下实验方案:
|
序号 |
A |
B |
C |
D |
E |
|
仪器及药品 |
 |
 |
 |
 |
 |
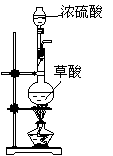
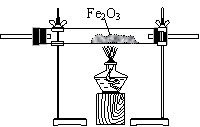
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。
(制取CO的原理为:H2C2O4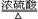 CO2↑+CO↑+H2O)
CO2↑+CO↑+H2O)
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 → → → → 。
(2)正确的操作第一步应是 ;最后一步应是
熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用
是 。
第二步 :将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
(4)必须进行的操作是 。
第三步:得到纯净的FeCl2晶体。
(5)必须进行的操作是 。
22(10分)、工业上用饱和食盐水作原料,用电解方法制取烧碱。 (1)写出电极反应和总化学方程式:阳极______________________,阴极_________________________;总反应________________________。 (2)NaOH在_________极附近生成; (3)电极材料为石墨和铁网,阳极必须用_________,原因是
___________________________________________; (4)电解过程中可能发生的副反应有两个,它们是: ______________________________________,
(5)若将电解槽内的隔膜去掉,同时升高电解液的温度,此时电解产物间发生反应:NaOH+Cl2→NaClO3+NaC1+H2O(未配平),假设反应进行完全,则在该条件下最后得到的两种产物的物质的量之比是______________
(6)若在NaClO3溶液中加入固体KCl,则可得到重要工业产品KClO3晶体,其原因是_______________________________________________。
23(10分)、如下图所示,A溶液呈蓝色。(图中参加反应的水及生成的水已略去) 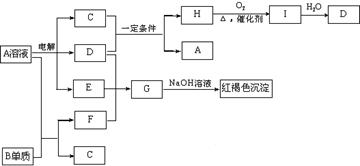 请回答下列问题:
(1)写出电解A溶液的离子方程式:
;
(2)写出C和D在一定条件下反应的化学方程式:
;
(3)写出G的化学式:
;
(4)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的正极材料可以是: ;负极的反应式是:
。
24(10分)、取0.04molKMnO4固体,加热一段时间后将剩余固体与浓盐酸共热,收集到气体 V(L)(标准状况)。若KMnO4的分解率为x ,HCl挥发忽略不计,与盐酸反应后Mn元素全部以Mn2+存在,则:
请回答下列问题:
(1)写出电解A溶液的离子方程式:
;
(2)写出C和D在一定条件下反应的化学方程式:
;
(3)写出G的化学式:
;
(4)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的正极材料可以是: ;负极的反应式是:
。
24(10分)、取0.04molKMnO4固体,加热一段时间后将剩余固体与浓盐酸共热,收集到气体 V(L)(标准状况)。若KMnO4的分解率为x ,HCl挥发忽略不计,与盐酸反应后Mn元素全部以Mn2+存在,则:
(1)V= L(用含x的代数式表示)。
(2)当x= 时,V的值最水,其值为 L。
(3)当V=2.016L时,第一次加热所得固体的质量为 g。
20、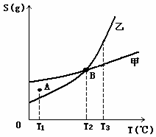 甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
A、A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
B、B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物
质的量浓度相等
C、将T3℃时甲、乙两物质的饱和溶液分别降温至T2℃,析出的
乙比析出的甲多
D、若乙中含有少量的甲,可用重结晶的方法提纯乙
第І卷 (非选择题,共40分
19、已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 KJ热量,下列热化学方程式正确的是 ( )
A. H2O(g) == H2(g)+1/2 O2(g); △H1=+242 kJ·mol-1
B. 2 H2(g)+ O2(g)===2 H2O(l); △H2=- 484 kJ·mol-1
C. H2(g)+1/2 O2(g)====H2O(g) ; △H1=+242 kJ·mol-1
D. 2 H2(g)+ O2(g)===2 H2O(g); △H2=+484 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com