
题目列表(包括答案和解析)
1.下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是
①Na2SiO3;②AlCl3;③NH4HCO3;④Al2O3;⑤NaHSO4
A.①②④ B.②③⑤ C.②③ D.③④
5.(10分)碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
(1)在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
|
时间 |
起始 |
14min后 |
30min后 |
75min后 |
|
pH |
<2.0 |
=2.5 |
<3.5 |
=3.5 |
试解释排气管中放出气体的pH变化的原因________________________ __________
__ _如果把排气管加长一倍,排气的pH_________(回答“增大”“减小”或“不变化”),解释原因___________________________________________________________ _ ___
(2)上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这种物质是__________________,为什么此时会有沉淀析出________________________________________________ __
4.(10分)由短周期元素组成的10种物质A-J间有下图所示的转化关系。已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成。试回答:
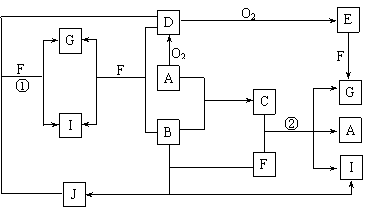
⑴工业生产中实现“D+O2 → E”转化的设备是 。
⑵反应①的离子方程式为 。
⑶足量铁与G的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g液态F吸收49gE气体生成液态G时放出热量65.15kJ,则表示该反应的热化学方程式为 。
⑸C是一种重要的化工产品,为易挥发樱桃红色液体。若反应②中G和A的物质的量之比为1∶2,则C的电子式为 。
3.(10分)中学化学中几种常见物质的转化关系如下:
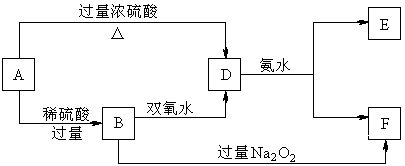
已知A→D的反应必须加热,否则会发生钝化现象。请回答下列问题:
(1)B、D、E的化学式依次为 、 、 。
(2)写出B的酸性溶液与双氧水反应的离子方程式: 。
(3)写出B和过量过氧化钠反应生成F的化学方程式
。
2.(10分)钛被称为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”。
(1)二氧化钛在现代社会里有广泛的用途,它的产量是一个国家国民经济发展程度的标志。我国至今产量不足,尚需进口二氧化钛。“硫酸法”生产二氧化钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质),主要生产流程是:
(1)将钛铁矿与浓H2SO4煮解: FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O
(硫酸钛酰)
|
(3)煅烧TiO2·nH2O===TiO2+nH2O
“硫酸法”生产TiO2排放的废液对水体有哪些污染,请指出主要的二点:
① ;
② 。
根据废液主要成分,针对其中一项污染,提出处理的方法。③
(2)某化学兴趣小组对Mg、Ti、Cu三种金属的金属活动性顺序进行探究。
提出假设:a. Ti金属活动性比Mg强;b. Ti金属活动性比Cu弱。
查阅资料:在相同条件下,金属与酸反应产生气泡的速度快,则该金属活动性越强。
实验设计:同温下,取大小相同的这三种金属薄片,用砂布将表面擦光亮,分别投入等体积等浓度的足量稀盐酸和稀HF溶液中反应,观察现象。
①稀盐酸:放出H2速率 Mg>Ti,铜不反应。 ②稀HF:放出H2速率 Ti>Mg
根据上述 现象(填①或②)得出金属活动性Mg Ti。如何解释另一反常现象 。
1.(10分)中学化学中有很多物质可以实现下图中物质之间的转化。其中反应条件和部分反应的产物已略去。液体B和C可能是单一溶质的溶液,也可能是纯净物。
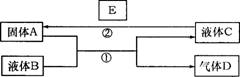 (1)若A是一种紫红色金属,气体D能
(1)若A是一种紫红色金属,气体D能
使品红溶液褪色,加热时又恢复原色。写出
反应①的化学方程式
该气体D与另一种气体H混合后生成一种淡黄色固体w,写出该反应的化学方程式
(2)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液 (填“能”、“否”)。
(3)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色。
写出反应①的离子方程式
写出反应②的任意一个离子方程式
16. (10分)右图是一种常见有机物A的分子结构比例模型。
(10分)右图是一种常见有机物A的分子结构比例模型。
⑴写出A的结构简式____________________。
⑵当有机物分子中碳原子通过四个单键与不同原子(或原子团)相连时,该碳原子为手性碳原子。判断A中手性碳原子数__________个。
⑶通过两种反应可以使A中手性碳原子失去手性,写出反应类型:________、________。
⑷请设计合理方案由丙烯制备A(用反应流程图表示并注明反应条件)。
例:由乙醇合成聚乙烯的反应流程图可表示为:
 CH3CH2OH
CH2=CH2
CH3CH2OH
CH2=CH2 [CH2-CH2]n
[CH2-CH2]n
15. (8分)某二元醇A,含氧的质量分数为27.1%,其余是碳和氢。A有如下图转化关系,在转化的过程中碳原子连接方式可能发生变化,A、B、C、D分子结构中都有4个甲基,且均为链状结构。(已知有机物中同一碳上连接两个羟基不稳定)
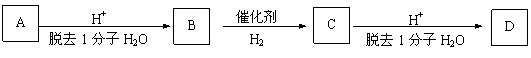
回答下列问题:
(1)A的相对分子质量是: 。
(2)A和D的结构简式分别是 和 。
(3)B转化为C的化学方程式是(有机物用结构简式表示):
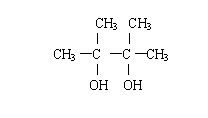 。
。
14.(6分)有机物分子中当有一个碳与四个不同的基团相连接时,该物质具有旋光性。如乳酸(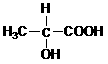 )就有旋光性。
)就有旋光性。
某酯具有旋光性,分子式为C6H12O2。该酯在酸性条件下水解。经分离得相应的酸和醇。
(1) 若生成的酸有旋光性,对应酯的结构简式为______________ (2) 若生成的醇有旋光性,满足此条件的酯有______________种
(3) 该酯经水解后所得水解混合物是否一定有旋光性?_____ ______(要说明原因)
13.(10分)医学研究成果显示,从八角茴香中提取到的莽草酸具有抗炎、镇痛作用,是合成某些抗癌药物的中间体。莽草酸的分子结构模型如图所示(分子中只有C、H、O三种原子)。
请回答下列问题:
⑴观察右图分子结构模型,写出莽草酸分子中能发生取代反应的官能团的名称_____________________。
⑵莽草酸跟有机物A在一定条件发生酯化反应,可生成一种相对分子质量为188的酯类物质。A的结构简式为_____________。
⑶莽草酸在一定条件下可以发生消去反应,能生成一种芳香族化合物,写出该物质的结构简式 。
⑷环状有机物B是莽草酸的同分异构体,1mol该有机物与足量的银氨溶液反应生成4mol金属银;1mol该有机物与足量的金属钠反应生成1.5molH2。试写出符合上述条件的有机物B的结构简式________________________(写一种)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com